Podela ćelija je generativna iskra skoro svakog oblika života na Zemlji. Ali ako se zdrav rast ne kontroliše, podela ćelija može postati smrtonosna, preplavljujući organizam. Takav je slučaj sa takozvanim onkogenima. Kada su izmenjeni mutacijom, ovi geni koji usporavaju rast se pokvare, proizvodeći kao rezultat gejzir ćelija raka.
Onkogeni su takođe podmuklo vešti u stvaranju tumora koji vremenom postaju genetski „nezavisni“ od svog porekla, tako da je naučnicima bilo izuzetno teško da zaustave njihovu replikaciju na izvoru.
Istraživači sa Univerziteta Rokfeler u Laboratoriji za ćelijsku biologiju otkrili su novi način da ciljaju onkogen iza retkog i često smrtonosnog oboljenja jetre koristeći male interferirajuće RNK (siRNA), urođeni mehanizam za utišavanje ekspresije gena.
Kao što je opisano u svom članku objavljenom u Molekularnoj terapiji, istraživači su ubacili siRNA unutar ćelija fibrolamelarnog hepatocelularnog karcinoma (FLC) kroz površinski receptor, gde su blokirali onkogen da proizvodi proteine koji izazivaju bolest i koji dovode do formiranja tumora.
To je prvi put da su siRNA korišćene za usporavanje progresije FLC-a, kaže prvi autor Kristof Nojmajer, student doktorskih studija u Rokfelerovoj Laboratoriji za ćelijsku biologiju, na čelu sa Sanfordom Sajmonom.
Ali nalazi imaju i širu primenu. „To je zaista uzbudljiv deo“, kaže Nojmajer. „Ovo je dokaz koncepta da se siRNA mogu koristiti za FLC, kao i kod odraslih kancera jetre, koji su mnogo češći, i drugih tipova tumora na drugim mestima u telu.“
FLC je uzrokovan fuzijom dva gena koja se nalaze na hromozomu 19: DNAJB1, koji proizvodi proteine toplotnog šoka koji podstiču ćelijsku homeostazu, i PRKACA, koji proizvodi enzim koji se zove kinaza A koji je ključan za ćelijsku metaboličku funkciju. Dobijena fuzija, poznata kao DNAJB1::PRKACA, spaja proteine i katalitičku podjedinicu kinaze. Ovaj disfunkcionalni sindikat promoviše formiranje FLC-a, ali kako, tačno, još uvek nije poznato.
Istraživači u Simonovoj laboratoriji otkrili su da je ova fuzija izazvala FLC 2014. godine, nekoliko godina nakon što je Simonovoj kćerki tinejdžerki, Elani, dijagnosticirana bolest jetre. Nakon uklanjanja nastalog tumora – jedine opcije lečenja koja je dostupna osobama sa FLC – Elana je nastavila da sarađuje sa svojim ocem kako bi otkrila njegov uzrok, objavivši rezultate u časopisu Science 2014.
Od tada, Sajmon i njegova grupa su nastavili da otkrivaju mehanizme iza ove bolesti, kao i da razvijaju terapiju. Istraživanje siRNA je deo strategije od tri dela koja takođe uključuje prenamenu lekova za lečenje FLC-a i korišćenje molekula poznatih kao PROTAC za selektivnu degradaciju proteina DNAJB1::PRKACA koji pokreće FLC.
Prenamena leka je u naprednoj pripremi za kliničko ispitivanje, a deo rada PROTAC-a deo je međunarodne saradnje koja je upravo dobila grant od 25 miliona dolara za Cancer Grand Challenges za razvoj tretmana za visokorizične karcinome izazvane onkogenom kod dece.
Nedavno je Simonova laboratorija otkrila da mogu potpuno zaustaviti rast FLC tumora kod miševa koristeći shRNA, kratke sekvence RNK koje se mogu konstruisati da poremete mRNA. Pristup je takođe prouzrokovao smanjenje ili nestanak mnogih tumora.
Pošto su pokazali da je gušenje spojenog onkogena ubilo tumorske ćelije, odlučili su da eksperimentišu sa izbacivanjem aktivnosti kinaze A, za koju je istraživanje pokazalo da pokreće rast tumora.
Problem je bio u tome što su fuzionisana kinaza A i njen oblik „divljeg tipa“ skoro identični, tako da bi „svaki lek koji ste razvili koji blokira aktivnost fuzionisane kinaze A uticao na sve kinaze A, uključujući i normalne ćelije“, kaže Neumaier. „Drugim rečima, imali biste niz problematičnih neželjenih efekata.“
Morali su da pronađu način da onemoguće toksičnu kinazu dok obuzdaju udar tako da kinaza u drugim ćelijama nije pogođena. Da bi to uradili, posebno su dizajnirali siRNA da ciljaju na fuziju. Ali pošto siRNA ne mogu da pređu ćelijske membrane, istraživači su morali da pronađu način da unesu siRNA unutra.
Srećom, vrata u ćeliju su već bila identifikovana: receptor nazvan ASGR1 koji se izražava samo u ćelijama jetre. Identifikovan je i njegov ključ: vezujući molekul poznat kao GalNAc. Zajedno, duo funkcioniše kao tim za odlaganje otpada.
GalNAc konjugatne terapije, koje vezuju siRNA molekule za ligand da bi isporučile terapije unutar ćelija, već su na tržištu za stanja kao što su nasledna amiloidoza posredovana transtiretinom i aterosklerotična kardiovaskularna bolest. Tim se pitao da li bi mogli da koriste isti pristup da spreče kinazu koja pokreće FLC tumore.
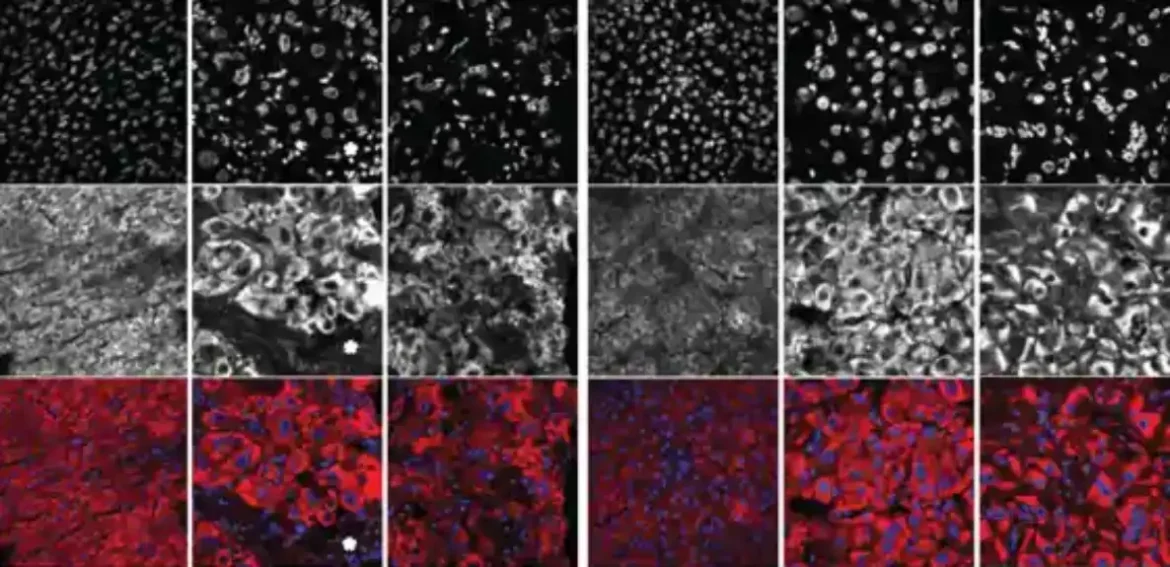
Da bi testirali svoju teoriju, istraživači su pričvrstili prilagođenu siRNA na ligand receptora i proučavali metodu na različitim modelima tumora kod miševa i u kulturama ljudskih ćelija. Konjugatna terapija ne samo da je uspešno uneta u ćelije u svim kontekstima, već je takođe izazvala smanjenje mRNK u onkogenu, sprečavajući proizvodnju proteina i rezultirajući stagnacijom ili smanjenjem tumora, nesposobnim da raste. Istraživači takođe nisu otkrili nikakvu toksičnost za jetru kod miševa, što ukazuje da životinje dobro tolerišu siRNA.
„Ono što smo videli je inhibicija tumora, kada smo se nadali da ćemo potpuno ubiti tumor“, primećuje Neumaier. „Naš budući pravac će biti da pokušamo da shvatimo kako da to poboljšamo.
Takođe su testirali specifičnost siRNA tako što su je ubrizgali u tumorske ćelije druge vrste raka jetre. Nije imalo toksičan uticaj na njih – baš kako su se istraživači nadali. „Želeli smo da pokažemo da je naša siRNA toliko usmerena na FLC fuzioni onkogen da nema neželjenih efekata na druge ćelije — čak ni na druge ćelije raka“, primećuje on.
Neumaier kaže da nalazi sugerišu da siRNA mogu biti efikasne izvan FLC-a, sposobne da leče tumore u celom telu sa visokim stepenom specifičnosti. „Mislim da će siRNA lekovi kao klasa imati veliki uticaj tokom vremena kao nova vrsta genetske terapije“, kaže on.