Kroz godine inženjering sistema za uređivanje gena, istraživači su razvili skup alata koji omogućavaju modifikaciju genoma u živim ćelijama, slično „hirurgiji genoma“. Ovi alati, uključujući one zasnovane na prirodnom sistemu poznatom kao CRISPR/Cas9, nude ogroman potencijal za rešavanje nezadovoljenih kliničkih potreba, što je naglašeno nedavnim odobrenjem FDA za prvu terapiju zasnovanu na CRISPR/Cas9.
Relativno novi pristup pod nazivom „prime editing“ omogućava uređivanje gena sa izuzetnom preciznošću i velikom svestranošću, ali ima kritični kompromis: promenljivu i često nisku efikasnost instalacije uređivanja. Drugim rečima, dok se glavne izmene mogu napraviti sa velikom preciznošću i sa nekoliko neželjenih nusproizvoda, pristup takođe često ne uspe da izvrši te izmene na razumnoj frekvenciji.
U radu koji je objavljen u časopisu Priroda 18. aprila 2024. godine, naučnici sa Prinstona Jun Jan i Brit Adamson, zajedno sa nekoliko kolega, opisuju efikasnijeg glavnog urednika.
Osnovni sistemi za uređivanje se minimalno sastoje od dve komponente: modifikovane verzije proteinskog elementa CRISPR/Cas9 i molekula ribonukleinske kiseline (RNA) zvanog pegRNA. Ove komponente rade zajedno u nekoliko koordinisanih koraka: Prvo, pegRNA vezuje protein i vodi nastali kompleks do željene lokacije u genomu.
Tamo, protein seče DNK i, koristeći šablonsku sekvencu kodiranu na pegRNA, „obrnuto transkribuje“ izmene u genom u blizini. Na ovaj način, glavni urednici „upisuju“ tačne sekvence u ciljanu DNK.
„Prime editing je tako neverovatno moćan alat za uređivanje genoma jer nam daje veću kontrolu nad tačno kako se menjaju genomske sekvence“, rekao je Adamson.
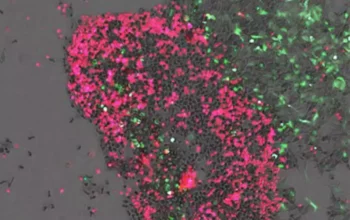
Na početku svoje studije, Adamson i Jan, diplomirani student u Adamsonovoj istraživačkoj grupi i Odeljenju za molekularnu biologiju, zaključili su da nepoznati ćelijski procesi mogu pomoći ili ometati prvo uređivanje. Da bi identifikovao takve procese, Jan je izneo konceptualno jednostavan plan: prvo bi konstruisao ćelijsku liniju koja bi emitovala zelenu fluorescenciju kada bi se instalirale određene glavne izmene. Zatim bi sistematski blokirao ekspresiju proteina koji se normalno eksprimiraju u tim ćelijama i merio fluorescenciju izazvanu uređivanjem da bi odredio koji od tih proteina utiče na prvo uređivanje.
Sprovođenjem ovog plana, tim je identifikovao 36 ćelijskih determinanti primarnog uređivanja, od kojih je samo jedna – mali protein La koji vezuje RNK – promovisao uređivanje.
„Iako promovisanje primarnog uređivanja očigledno nije normalna funkcija La proteina, naši eksperimenti su pokazali da može snažno olakšati proces“, rekao je Jan.
Poznato je da u ćelijama La vezuje specifične sekvence koje se često nalaze na krajevima malih RNK molekula u nastajanju i štiti te RNK od degradacije. Tim iz Prinstona je odmah prepoznao da pegRNA korišćene u prvim Janovim eksperimentima verovatno sadrže te tačne sekvence, nazvane poliuridinski traktovi, jer su tipičan, ali često zanemaren nusprodukt ekspresije pegRNA u ćelijama. Naknadni eksperimenti sugerisali su da takve pegRNA nenamerno koriste La-ovu aktivnost krajnjeg vezivanja za zaštitu i promovisanje primarnog uređivanja.
Motivisani njihovim rezultatima, tim je pitao da li spajanje dela La koji vezuje poliuridinske trakte sa standardnim proteinom za prvo uređivanje može povećati efikasnost primarne montaže. Bili su oduševljeni kada su otkrili da je dobijeni protein, koji oni nazivaju PE7, značajno poboljšao predviđenu efikasnost primarnog uređivanja u svim uslovima i, kada su koristili neke sisteme za prvo uređivanje, ostavio je učestalost neželjenih nusproizvoda veoma niskim.
Njihovi rezultati brzo su privukli pažnju kolega zainteresovanih za korišćenje primarnog uređivanja u primarnim ljudskim ćelijama, uključujući Daniela Bauera iz Bostonske dečje bolnice i Harvardske medicinske škole i Aleksandra Marsona sa Kalifornijskog univerziteta u San Francisku. Zajedno sa naučnicima iz ovih laboratorija, tim istraživača je nastavio da demonstrira da PE7 takođe može poboljšati efikasnost uređivanja u terapijski relevantnim tipovima ćelija, nudeći prošireno obećanje za buduće kliničke primene.
„Ovaj rad je prelep primer koliko duboko ispitivanje unutrašnjeg rada ćelija može dovesti do neočekivanih uvida koji mogu dati kratkoročni biomedicinski uticaj“, primetio je Bauer.