Davanje lekova u različito doba dana može značajno uticati na to kako se oni metabolišu u jetri, prema novoj studiji MIT-a.
Koristeći male, projektovane jetre dobijene od ćelija ljudskih donatora, istraživači su otkrili da su mnogi geni uključeni u metabolizam lekova pod cirkadijalnom kontrolom. Ove cirkadijalne varijacije utiču na to koliko je leka dostupno i koliko efikasno telo može da ga razgradi. Na primer, otkrili su da su enzimi koji razgrađuju Tilenol i druge lekove u izobilju u određeno doba dana.
Sve u svemu, istraživači su identifikovali više od 300 gena jetre koji prate cirkadijalni sat, uključujući mnoge uključene u metabolizam lekova, kao i druge funkcije kao što je zapaljenje. Analiza ovih ritmova mogla bi pomoći istraživačima da razviju bolje rasporede doziranja za postojeće lekove.
„Jedna od najranijih primena ove metode mogla bi biti fino podešavanje režima lekova već odobrenih lekova kako bi se maksimizirala njihova efikasnost i minimizirala njihova toksičnost“, kaže Sangeeta Bhatia, profesor zdravstvenih nauka i tehnologije i elektrotehnike Džona i Doroti Vilson. Računarske nauke na MIT-u i član MIT-ovog Koh instituta za integrativno istraživanje raka i Instituta za medicinsko inženjerstvo i nauku (IMES).
Studija je takođe otkrila da je jetra podložnija infekcijama kao što je malarija u određenim tačkama cirkadijalnog ciklusa, kada se proizvodi manje inflamatornih proteina.
Bhatia je stariji autor nove studije, koja se danas pojavljuje u Science Advances. Glavni autor rada je Sandra Marč, naučnica u IMES-u.
Procenjuje se da oko 50% ljudskih gena prati cirkadijalni ciklus, a mnogi od ovih gena su aktivni u jetri. Međutim, istraživanje kako cirkadijalni ciklusi utiču na funkciju jetre bilo je teško jer mnogi od ovih gena nisu identični kod miševa i ljudi, tako da se modeli miša ne mogu koristiti za njihovo proučavanje.
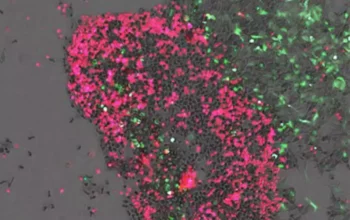
Bhatijina laboratorija je ranije razvila način da uzgaja minijaturizovane jetre koristeći ćelije jetre zvane hepatociti, od ljudskih donatora. U ovoj novoj studiji, ona i njene kolege su krenule da istraže da li ove projektovane jetre imaju svoje cirkadijalne satove.
Radeći sa grupom Čarlsa Rajsa na Univerzitetu Rokfeler, identifikovali su uslove kulture koji podržavaju cirkadijalni izraz gena sata zvanog Bmal1. Ovaj gen, koji reguliše cikličnu ekspresiju širokog spektra gena, omogućio je ćelijama jetre da razviju sinhronizovane cirkadijalne oscilacije. Zatim su istraživači merili ekspresiju gena u ovim ćelijama svaka tri sata tokom 48 sati, omogućavajući im da identifikuju više od 300 gena koji su bili izraženi u talasima.
Većina ovih gena grupisana je u dve grupe – oko 70% gena je dostiglo vrhunac zajedno, dok je preostalih 30% bilo na najnižoj tački kada su ostali dostigli vrhunac. Ovo uključuje gene uključene u različite funkcije, uključujući metabolizam lekova, metabolizam glukoze i lipida i nekoliko imunoloških procesa.
Kada su projektovane jetre uspostavile ove cirkadijalne cikluse, istraživači bi ih mogli koristiti da istraže kako cirkadijalni ciklusi utiču na funkciju jetre. Prvo su krenuli da proučavaju kako doba dana utiče na metabolizam lekova, posmatrajući dva različita leka — acetaminofen (Tilenol) i atorvastatin, lek koji se koristi za lečenje visokog holesterola.
Kada se Tilenol razgradi u jetri, mali deo leka se pretvara u toksični nusproizvod poznat kao NAPKI. Istraživači su otkrili da količina proizvedenog NAPKI može varirati do 50%, u zavisnosti od toga u koje doba dana se lek primenjuje. Takođe su otkrili da atorvastatin stvara veću toksičnost u određeno doba dana.
Oba ova leka se delimično metabolišu enzimom zvanim CIP3A4, koji ima cirkadijalni ciklus. CIP3A4 je uključen u obradu oko 50% svih lekova, tako da istraživači sada planiraju da testiraju više tih lekova koristeći svoje modele jetre.
„U ovom skupu lekova, biće od pomoći da se identifikuje doba dana za primenu leka kako bi se postigla najveća efikasnost leka i minimizirali neželjeni efekti“, kaže Marč.
Istraživači sa MIT-a sada rade sa saradnicima na analizi leka protiv raka za koji sumnjaju da bi mogao biti pod uticajem cirkadijalnih ciklusa, i nadaju se da će istražiti da li to može biti tačno i za lekove koji se koriste u lečenju bola.
Mnogi geni jetre koji pokazuju cirkadijalno ponašanje uključeni su u imunološke odgovore kao što je upala, pa su se istraživači pitali da li ova varijacija može uticati na podložnost infekciji. Da bi odgovorili na to pitanje, izložili su projektovane jetre Plasmodium falciparum, parazitu koji izaziva malariju, u različitim tačkama cirkadijalnog ciklusa.
Ove studije su otkrile da je veća verovatnoća da će jetra biti inficirana nakon izlaganja u različito doba dana. Ovo je zbog varijacija u ekspresiji gena koji se nazivaju geni stimulisani interferonom, koji pomažu u suzbijanju infekcija.
„Signali upale su mnogo jači u određenim periodima dana od drugih“, kaže Bhatia. „To znači da bi virus poput hepatitisa ili parazita poput onog koji izaziva malariju mogao bolje da se zadrži u vašoj jetri u određeno doba dana.“
Istraživači veruju da do ove ciklične varijacije može doći zato što jetra slabi svoj odgovor na patogene nakon obroka, kada je obično izložena prilivu mikroorganizama koji mogu izazvati upalu čak i ako nisu štetni.
Bhatia laboratorija sada koristi prednosti ovih ciklusa za proučavanje infekcija koje je obično teško ustanoviti u projektovanoj jetri, uključujući infekcije malarije uzrokovane parazitima koji nisu Plasmodium falciparum.
„Ovo je veoma važno za teren, jer samo postavljanjem sistema i odabirom pravog vremena infekcije možemo povećati stopu infekcije naše kulture za 25%, omogućavajući preglede lekova koji su inače bili nepraktični“, kaže Marč.