U značajnoj studiji, međunarodni konzorcijum predvođen istraživačima iz Dečje bolnice u Filadelfiji (CHOP) objavio je konačne rezultate ključnog kliničkog ispitivanja genske terapije CASGEVI (ekagamglogene autotemcel) za lečenje bolesti srpastih ćelija kod pacijenata starijih od 12 godina sa rekurentnim vazookluzivnim krizama (VOC).
Studija je otkrila da 96,7% pacijenata u studiji nije imalo nijednu vazookluzivnu krizu (VOC) – blokadu koja dovodi do nedostatka kiseonika i bolnih epizoda – najmanje godinu dana, a 100% je bilo u stanju da ostane na bolničkom lečenju. besplatno isto vreme.
Nalazi, objavljeni u časopisu Nev England Journal of Medicine, pružaju potpune detalje kritičnog kliničkog ispitivanja koje je dovelo do odobrenja FDA za CASGEVI za lečenje bolesti srpastih ćelija u decembru 2023.
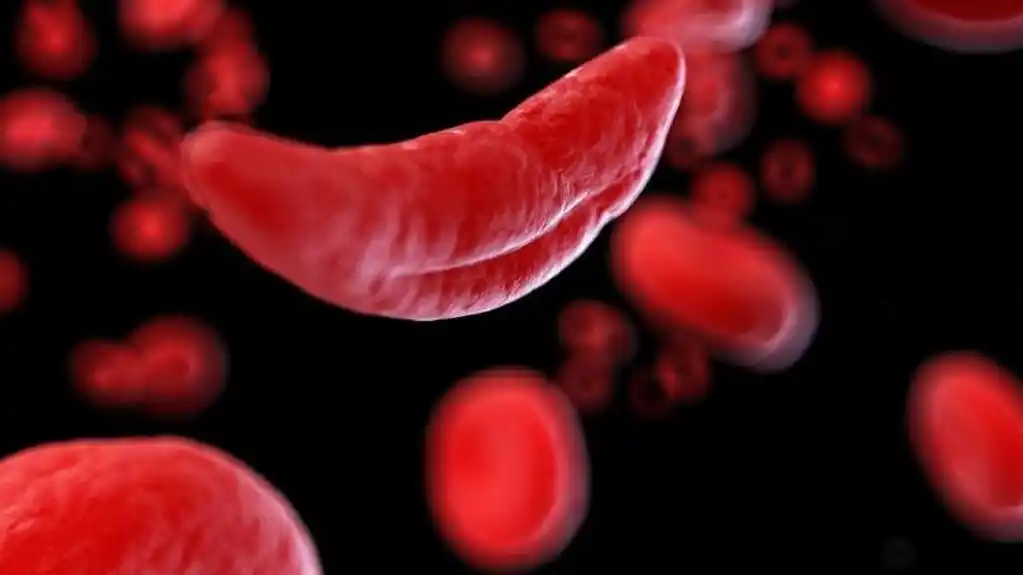
Bolest srpastih ćelija je doživotno stanje koje izaziva intenzivan bol zbog deformisanih krvnih zrnaca koje mogu izazvati blokade krvnih sudova. Ovo takođe može dovesti do moždanog udara, oštećenja organa i skraćenog života.
Istraživači su proučavali upotrebu genske terapije i CRISPR tehnologije za uređivanje delova DNK kod ljudi sa naslednim ili genetskim poremećajima, kao što je bolest srpastih ćelija. U slučaju bolesti srpastih ćelija, CASGEVI proces uređuje DNK unutar sopstvenih ćelija pacijenta i omogućava pacijentu da proizvede drugačiji oblik hemoglobina u svojim crvenim krvnim zrncima.
Klinička ispitivanja na CHOP-u i drugim lokacijama pokazala su da uspešno uređivanje gena može sprečiti ćelije da razviju karakterističan oblik polumeseca koji je očigledan kod bolesti srpastih ćelija i eliminiše epizode bola kod skoro svih pacijenata. CASGEVI je bila prva terapija koju je odobrila FDA i razvijena pomoću CRISPR tehnologije.
„U ovom kliničkom ispitivanju, pacijenti sa srpastim ćelijama koji su imali značajne probleme sa svojom bolešću počeli su da vide kako se njihovi problemi rešavaju u roku od nekoliko meseci i značajno poboljšavaju kvalitet života“, rekao je viši autor studije Stephan A. Grupp, dr. Šef odeljenja Odeljenja za ćelijsku terapiju i transplantaciju, inauguracioni direktor Centra za imunoterapiju raka Suzan S. i Stiven P. Keli i medicinski direktor Laboratorije za ćelijsku i gensku terapiju u CHOP-u.
Grupp je takođe bio jedan od glavnih istraživača u kliničkim ispitivanjima koja su dovela do odobrenja CASGEVI-ja i vođe upravnog odbora studije.
Istraživači su sproveli ispitivanje CLIMB SCD-121, fazu III, jednostruku, otvorenu studiju eka-cel-a kod pacijenata između 12 i 35 godina starosti sa bolešću srpastih ćelija i najmanje dva teška VOC u svakoj od dve godine. pre skrininga. Ključna primarna krajnja tačka studije bila je proporcija pacijenata bez teških VOC tokom najmanje 12 uzastopnih meseci, sa sekundarnom krajnjom tačkom pacijenata koji nisu bili hospitalizovani zbog teških VOC tokom najmanje 12 uzastopnih meseci.
Ukupno 44 pacijenata je primilo eka-cel sa srednjim praćenjem od 19,3 meseca. Od ukupno 30 pacijenata sa dovoljno podataka o praćenju za procenu, 29 (96,7%) je bilo bez VOC-a najmanje 12 uzastopnih meseci.
Ove informacije su ažurirane informacije o američkim informacijama o prepisivanju za CASGEVI, koje uključuju procenu 31 pacijenta što je rezultiralo stopom odgovora od 93,5%. Bezbednost lečenja bila je uporediva sa lečenjem hematopoetskim i progenitornim matičnim ćelijama, a kao rezultat lečenja nisu prijavljeni maligniteti.
Pored toga, rezultati kliničkog ispitivanja o efikasnosti eka-cel-a za lečenje β-talasemije takođe su objavljeni u Nev England Journal of Medicine. Preliminarni rezultati ispitivanja doveli su do odobrenja FDA za CASGEVI za β-talasemiju zavisnu od transfuzije u januaru 2024. Grupp je takođe bio jedan od glavnih istraživača za ovo kliničko ispitivanje.