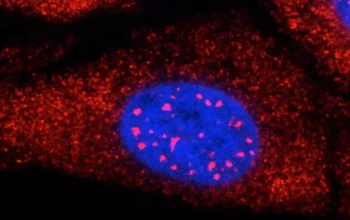
Istraživači LMU demonstriraju na modelu zebrice da dva proteina sprečavaju stvaranje ožiljaka u mozgu, čime se poboljšava sposobnost tkiva da se regeneriše.
Dok se ćelije redovno obnavljaju u većini endogenih tkiva, broj nervnih ćelija u ljudskom mozgu i kičmenoj moždini ostaje konstantan. Iako nervne ćelije mogu da se regenerišu u mozgu odraslih sisara, kao što je ranije pokazala naučnica sa LMU-a, profesorka Magdalena Goc, mladi neuroni kod pacijenata sa povredama mozga nisu u stanju da se integrišu u postojeće neuronske mreže i prežive, izvan dve specifične oblasti mozga.
Čini se da je to zbog glijalnih ćelija, koje formiraju potporno tkivo u mozgu. Microglia posebno izaziva upale i dovode do ožiljaka koji izoluju povređeno mesto od zdravog mozga, ali dugoročno sprečavaju pravilno ugrađivanje novih neurona u kola. Kako telo reguliše takve mehanizme, ranije je bilo nepoznato.
Sada je tim predvođen LMU ćelijskim biologom prof. Jovicom Ninkovićem pokazao u Nature Neuroscience da je smanjenje reaktivnosti mikroglije ključno za sprečavanje hroničnih upala i ožiljaka tkiva, a samim tim i za poboljšanje sposobnosti regeneracije.
Za razliku od sisara, centralni nervni sistem (CNS) zebrice ima izuzetne regenerativne moći. U slučaju povrede, nervne matične ćelije stvaraju dugovečne neurone, između ostalih odgovora. Štaviše, povrede CNS-a izazivaju samo prolaznu reaktivnost glijalnih ćelija u zebri, što olakšava integraciju nervnih ćelija u povređene regione tkiva. „Ideja je bila da se otkriju razlike između zebrice i sisara kako bismo razumeli koji signalni putevi u ljudskom mozgu inhibiraju regeneraciju — i kako bismo mogli da intervenišemo“, kaže Ninković.
Naučnici su namerno naneli lezije CNS-a zebri, što je dovelo do aktivacije mikroglije. U isto vreme, istraživači su otkrili akumulaciju lipidnih kapljica i TDP-43 kondenzata u lezijama. Do danas je protein TDP-43 prvenstveno povezan sa neurodegenerativnim oboljenjima.
Granulin je takođe igrao važnu ulogu u modelu zebrice . Ovaj protein je doprineo uklanjanju lipidnih kapljica i TDP-43 kondenzata, nakon čega je mikroglija prešla iz svog aktiviranog u oblik mirovanja. Ishod je bio regeneracija povrede bez ožiljaka. Zebrafiš sa eksperimentalno izazvanim nedostatkom granulina, nasuprot tome, pokazao je lošu regeneraciju povrede slično onome što vidimo kod sisara. „Sumnjamo stoga da granulin igra važnu ulogu u regeneraciji nerava kod zebrica“, kaže Ninković.
Da bi dalje pratio poređenje između ljudi i zebrice, Ninkovićev tim je istraživao materijal pacijenata koji su umrli od povreda mozga. I ovde je postojala korelacija između stepena aktivacije mikroglije i akumulacije lipidnih kapljica i TDP-43 kondenzata. Odgovarajući signalni putevi u ljudskom tkivu su stoga bili uporedivi sa onima u zebri.
Istraživač LMU vidi „potencijal za nove terapeutske primene kod ljudi.“ Kao sledeći korak, on planira da istraži da li su poznata jedinjenja niske molekularne težine pogodna za inhibiciju signalnih puteva aktivacije mikroglije, čime se promoviše zarastanje neuralnih lezija. Zebrafish modeli će se ponovo koristiti u ovoj pretkliničkoj fazi.