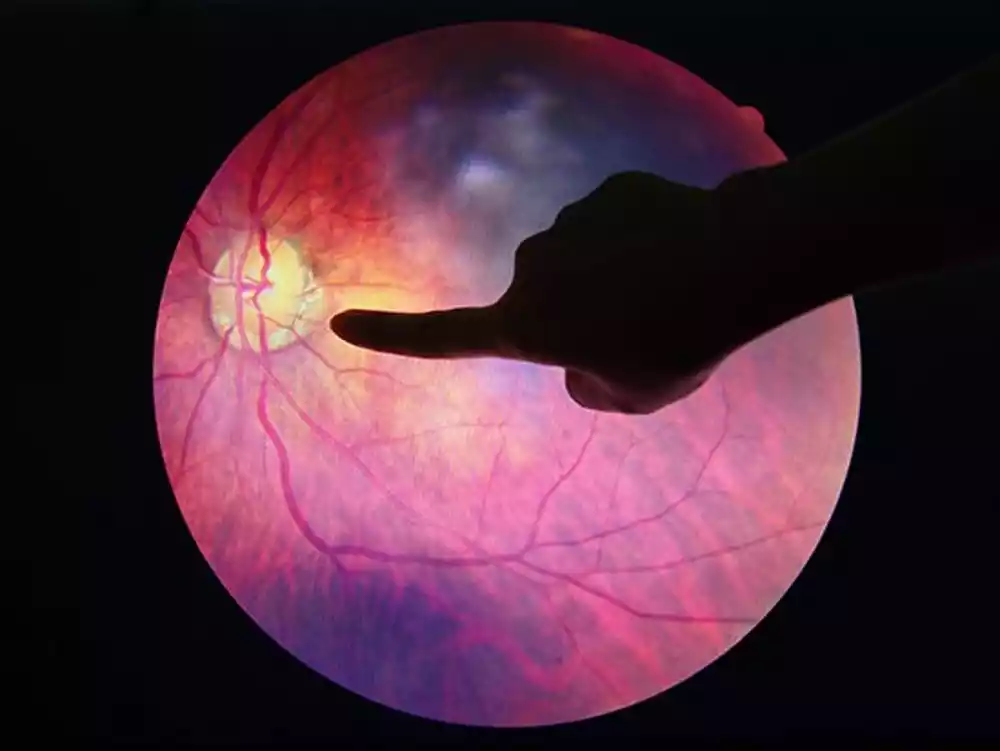
Vodeći uzrok slepila kod odraslih Amerikanaca je dijabetička retinopatija, progresivno oštećenje krvnih sudova u tkivu osetljivom na svetlost u zadnjem delu oka. Ipak, čini se da izvor ovog oštećenja leži u stomaku – uglavnom u tankom crevu koji propušta vodu koje slabi barijeru između crevnih bakterija i krvnog sistema, navodi se u studiji objavljenoj u časopisu Circulation Research.
Istraživačka krv ljudi sa dijabetesom tipa 1 i mišji model dijabetesa tipa 1 korišćeni su za istraživanje mehanizama koji leže u osnovi dijabetičke retinopatije. Rezultati pokazuju način da se eventualno spreči ili čak preokrene oštećenje oka.
„Prema našim saznanjima, ova studija predstavlja prvi put da je poremećaj barijere creva umešan u patogenezu dijabetičke retinopatije i takođe direktno povezuje curenje creva sa ozbiljnošću retinopatije kod ljudi sa dijabetesom tipa 1“, rekla je Marija Grant, dr. istraživački tim i profesor na Univerzitetu Alabama u Birmingemu, Odsek za oftalmologiju i vizuelne nauke.
Neka pozadina je korisna za razumevanje Grantovog istraživanja.
Prvo, poznato je da dijabetes tipa 1 disreguliše sistemski sistem renin-angiotenzin, ili RAS. RAS je sistem hormona i enzima koji reguliše krvni pritisak i druge metaboličke promene. Pored sistemske RAS, postoje i lokalne RAS mreže koje deluju u različitim tkivima. Jedan ključni enzim RAS je ACE2, ili enzim 2 koji konvertuje angiotenzin. Gubitak ACE2 kod dijabetesa aktivira vazoštetnu osu RAS i smanjuje vazoprotektivnu osu RAS. Intrigantno, u mišjem modelu dijabetesa tipa 1, hranjenje miševa modifikovanim sojem bakterije iz creva Lactobacillus paracasei, koji je projektovan da proizvodi humani ACE2, štiti miševe od progresije dijabetičke retinopatije. Konačno, poznato je da nedostatak ACE2 u crevima povećava propusnost creva i sistemsku upalu.
Studije na ljudima, objavljene u Circulation Research, upoređivale su ljude sa dijabetesom tipa 1 u odnosu na kontrolnu grupu. Subjekti sa dijabetesom tipa 1 su dalje stratifikovani u tri grupe: bez dijabetičke retinopatije, neproliferativna dijabetička retinopatija i ozbiljnija bolest koja se zove proliferativna dijabetička retinopatija. Merenjem nivoa određenih imunih ćelija i biomarkera u krvi, uključujući mikrobne antigene creva, istraživači su otkrili da ljudi sa retinopatijom imaju neregulisan sistemski RAS i duboke defekte propusnosti creva koji su aktivirali komponente adaptivnog i urođenog imunološkog odgovora. Štaviše, utvrđeno je da povećanje težine dijabetičke retinopatije korelira sa povećanim nivoima biomarkera permeabilnosti creva i mikrobnog antigena creva. Ovo je uključivalo povećane nivoe angiotenzina II, hormona RAS koji aktivira vazoštetnu osu RAS.
Koristeći model dijabetesa tipa 1 Akita miša, istraživači su miševima prvo dali Lactobacillus paracasei koji proizvodi ACE2, a koji je razvio Kiuhong Li, Ph.D., sa Univerziteta Florida, miševima oralno počevši od početka dijabetesa. Ovaj probiotički tretman sprečio je gubitak epitelnog ACE2 creva koji se obično viđa kod Akita miševa, i što je važno, sprečio je oštećenje crevnog epitela i endotelne barijere. Takođe je smanjio visok nivo šećera u krvi poznat kao hiperglikemija.
Kada je oralni tretman Lactobacillus paracasei koji proizvodi ACE2 obustavljen do šest meseci nakon što je dijabetes ustanovljen, taj odloženi tretman je preokrenuo disfunkciju barijere creva i dijabetičku retinopatiju koja je već nastala kod miševa, uključujući smanjenje broja oštećenih kapilara u mrežnjači.
Grant i kolege su takođe pronašli dokaze za nekoliko mehanizama koji su doprineli ACE2 smanjenom oštećenju crevne barijere i ACE2 snižavanju šećera u krvi. Da bi potvrdili rezultate modela Lactobacillus paracasei koji proizvodi Akita/ACE2, kreirali su drugi model — genetski modifikovani soj Akite koji prekomerno ekspresuje humani ACE2 u epitelnim ćelijama tankog creva.
„Značaj rada je što smo pokazali da disregulisani RAS creva dovodi do translokacije crevnih mikrobnih antigena u plazmu“, rekao je Grant. „Ovi bakterijski peptidi aktiviraju endotel preko receptora sličnih naplati, stvarajući inflamatorni endotel koji je snažno umešan u patogenezu vaskularnih bolesti, uključujući dijabetičku retinopatiju.
„Pokazali smo gubitak funkcije crevne barijere kod ljudi sa dijabetesom tipa 1 koristeći biomarkere barijere creva, a ovo povećanje permeabilnosti je povezano sa aktivacijom imunoloških ćelija dobijenih iz creva.“