Tim istraživača na čelu sa dr Hirotsuguom Odom sa CECAD klastera izvrsnosti za istraživanje starenja Univerziteta u Kelnu otkrio je ulogu specifičnog proteinskog kompleksa u određenim oblicima imunološke disregulacije. Rezultat može dovesti do novih terapijskih pristupa koji imaju za cilj smanjenje autoinflamacije i „popravku“ imunološkog sistema pacijenata koji pate od genetske disfunkcije ovog proteinskog kompleksa.
Studija „Bialelni ljudski gubitak funkcije SHARPIN-a izaziva autoinflamaciju i imunodeficijenciju“ objavljena je u časopisu Priroda imunologije.
LUBAC, linearni kompleks ubikvitina koji se sastoji od proteina HOIP, HOIL-1 i SHARPIN, odavno je prepoznat po svojoj kritičnoj ulozi u održavanju imunološke homeostaze. Prethodne studije sprovedene na modelima miševa razjasnile su duboke posledice gubitka SHARPIN-a, što dovodi do teškog dermatitisa usled prekomerne ćelijske smrti ćelija kože. Međutim, specifične implikacije nedostatka SHARPIN-a na ljudsko zdravlje do sada su ostale neuhvatljive.
Istraživački tim po prvi put izveštava o dve ljudske individue sa nedostatkom SHARPIN-a koje pokazuju simptome autoinflamacije i imunodeficijencije, ali neočekivano ne manifestuju dermatološke probleme kao što je naznačeno relevantnim životinjskim modelom.
Nakon daljeg istraživanja, ove osobe su pokazale put koji je ključan za imuni odgovor, takozvani kompromitovani kanonski NF-κB odgovor. Takođe su pokazali povećanu osetljivost na ćelijsku smrt posredovanu članovima superfamilije faktora tumorske nekroze (TNF). Tretman jedne osobe sa nedostatkom SHARPIN-a sa anti-TNF terapijama, koje specifično potiskuju ćelijsku smrt izazvanu TNF-om, rezultiralo je potpunim razrešenjem autoinflamacije na ćelijskom nivou i kliničkom prezentacijom.
Studija pokazuje da prekomerna i nekontrolisana ćelijska smrt igra ključnu ulogu u ljudskim genetskim inflamatornim bolestima. Odin tim je dodao nedostatak SHARPIN-a kao novog člana ljudskih genetskih inflamatornih bolesti, za koje predlažu da se nazovu „urođene greške ćelijske smrti“.
Studija je započeta u laboratoriji dr Dana Kastnera u Nacionalnom institutu za zdravlje (NIH) u SAD. Tamošnji naučnici su imali priliku da vide jednog pacijenta sa neobjašnjivim epizodama groznice u detinjstvu, artritisom, kolitisom i imunodeficijencijom.
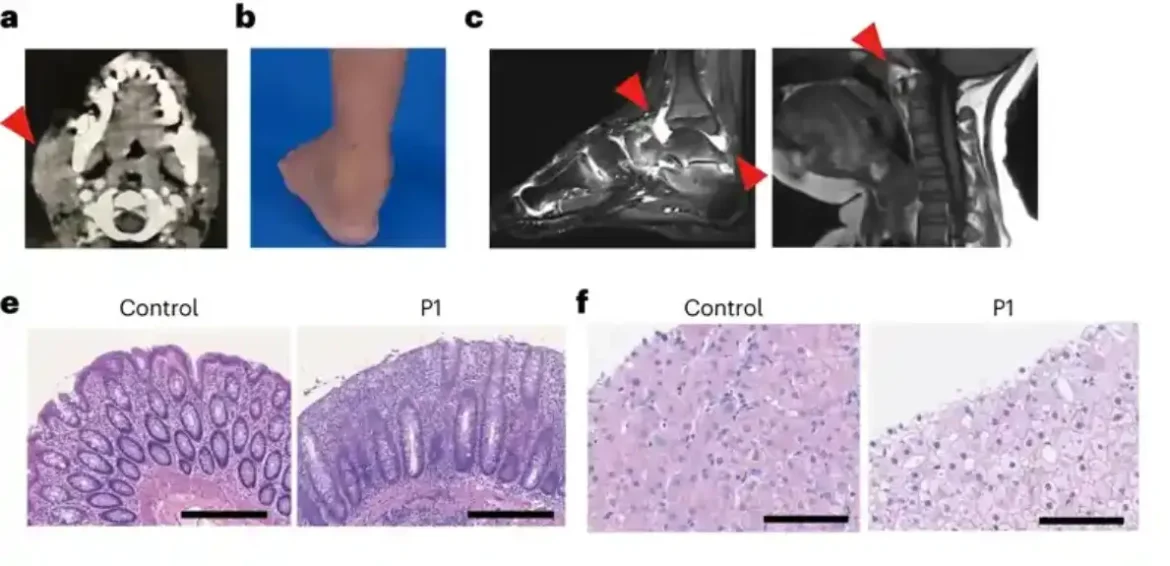
Nakon dobijanja informisanog pristanka, izvršili su sekvencioniranje egzoma kod pacijenta i članova porodice i otkrili da pacijent ima štetnu genetsku varijantu u SHARPIN genu, što je dovelo do nivoa SHARPIN proteina koji se ne može detektovati. Dalje su otkrili da ćelije pacijenata pokazuju povećanu sklonost ćelijskoj smrti kako u posudama za ćelijsku kulturu tako i u biopsijama pacijenata.
Tim je dalje primetio da je razvoj limfoidnih zametnih centara – specijalizovanih mikrostruktura u adenoidima koji su kritični za sazrevanje B ćelija našeg imunog sistema, a time i proizvodnju antitela – značajno smanjen zbog povećane smrti B ćelija. Ovi nalazi objašnjavaju imunodeficijenciju kod pacijenata i naglašavaju ključnu ulogu LUBAC-a u imunološkoj homeostazi kod ljudi.
„Naše istraživanje naglašava kritičnu važnost LUBAC-a u zaštiti od imunološke disregulacije. Razjašnjavajući molekularne mehanizme koji leže u osnovi nedostatka LUBAC-a, otvaramo put novim terapijskim strategijama koje imaju za cilj obnavljanje imunološke homeostaze“, rekao je Oda, vodeći autor studije.
Dodao je: „Jedan od pacijenata sa nedostatkom SHARPIN-a godinama je bio zavisan od invalidskih kolica pre nego što smo ga prvi put videli. Njegovi gležnjevi su bili upaljeni i bilo je previše bolno za hodanje. Genetska dijagnoza nam je omogućila da ciljamo pravi molekularni put koji leži u osnovi. njegove uslove“.
Otkako je stavljen na anti-TNF terapije, pacijent je bio bez simptoma skoro sedam godina. „Kao i kliničar i naučnik, oduševljen sam što imam priliku da kroz naše istraživanje pozitivno utičem na život jednog pacijenta“, zaključio je Oda.