Tim naučnika iz Nacionalne laboratorije u Brukhejvenu (DOE) američkog Ministarstva energetike i Univerziteta Kolumbija pokazao je način da se proizvedu velike količine receptora za koji se SARS-CoV-2, virus koji izaziva COVID-19, vezuje na površini. ljudskih ćelija. To vezivanje između sada ozloglašenog virusnog šiljka proteina i ljudskog „ACE2″ receptora je prvi korak infekcije virusom. Pravljenje funkcionalnog humanog ACE2 proteina u ćelijama miša daje naučnicima novi način da proučavaju ove receptore i potencijalno ih upotrebe. Pored toga, kao što je opisano u radu koji je upravo objavljen u časopisu Virologija, metoda bi mogla olakšati proučavanje drugih kompleksnih proteina za koje se pokazalo da je teško proizvesti na druge načine.
Prvobitni cilj naučnika iz Brukhejvena, na početku pandemije, bio je da naprave velike količine ljudskog ACE2, a zatim da prikače protein na nanočestice. Nanočestice obložene ACE2 mogu se zatim testirati kao antivirusni terapeutici i/ili kao senzori za otkrivanje virusnih čestica.
„Za bilo koju od ovih aplikacija, potrebne su vam velike količine proteina, a protein mora biti potpuno funkcionalan“, rekao je virolog iz Brookhaven Lab Paul Freimuth, koji je vodio istraživanje u saradnji sa naučnicima u Centru za funkcionalne nanomaterijale (CFN) u Brookhaven laboratoriji. „Ali stvaranje funkcionalnih membranskih proteina poput ACE2 je posebno izazovno jer je proces kojim se proteini lokalizuju u ćelijskoj membrani složen.“
Jedan od razloga je taj što su ovi proteini modifikovani na različite načine nakon što se sintetišu i pre nego što se ubace u ćelijsku membranu. Konkretno, molekuli ugljenih hidrata dodati proteinima igraju ključnu ulogu u tome kako se dugački proteinski lanac savija u svoju konačnu 3D strukturu i kako protein funkcioniše u membrani.
„Ugljeni hidrati čine oko jednu trećinu mase ACE2 proteina“, rekao je Freimuth.
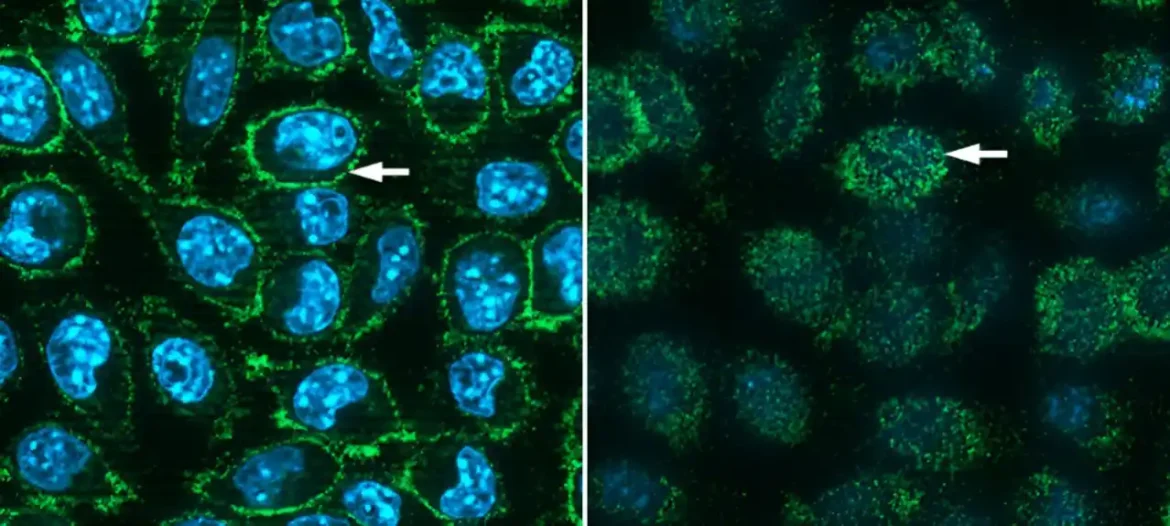
Najjednostavnijim ćelijama koje naučnici koriste za veštačko generisanje proteina, odnosno bakterijama, nedostaju enzimi za pričvršćivanje tih dodataka ugljenih hidrata. Dakle, tim iz Brookhejvena se okrenuo ćelijama miševa, koji su, kao sisari, više slični nama – i stoga su u stanju da urade istu vrstu obrade ugljenih hidrata. Poznato je da su ćelije miša vešte u prikupljanju i ekspresiji „stranih“ gena. I dok ćelije miša takođe prave ACE2 receptor, mišja verzija proteina se ne vezuje za SARS-CoV-2 šiljak. To znači da bi naučnici imali jednostavan način da vide da li ćelije miša prave ljudski ACE2 protein – tako što će videti da li će se šiljci vezati za ćelije.
Da bi se povećale šanse da će ćelije miša ugraditi i ispravno pročitati ljudski ACE2 gen, grupa je koristila netaknuti gen. Geni ljudi i drugih „viših organizama“ sadrže mnogo informacija pored sekvence DNK koja kodira aminokiselinske građevne blokove koji čine protein. Ove dodatne informacije pomažu u regulisanju strukture i funkcije gena unutar hromozoma ćelije.
Naučnici su pretraživali biblioteke kloniranih DNK fragmenata koji su generisani u okviru projekta Human Genome — napora koji sponzoriše DOE da se mapiraju lokacije svih gena koji nas čine ljudima — da bi pronašli fragment koji je sadržao netaknuti ACE2 gen, kompletan sa svojim ugrađenim regulatornim informacijama. Zatim su izložili ćelije miša nanočesticama obloženim ovim fragmentom DNK plus genom za drugi protein koji čini ćelije otpornim na smrtonosni antibiotik.
„U ovom slučaju, nanočestice služe kao agens za isporuku DNK koji biva zahvaćen ćelijama tako da se DNK potencijalno može integrisati u hromozome ćelije miša“, rekao je Freimuth. „Da bismo pronašli ćelije koje su pokupile strani gen(e), mi dodajemo antibiotik u ćelijske kulture. Ćelije koje nisu uspele da preuzmu i eksprimiraju gen otpornosti na antibiotike su umrle, dok su one koje su stekle otpornost na antibiotike preživele i prerasle u kolonije. .“
Naučnici su proširili oko 50 od tih kolonija u pojedinačne kulture, a zatim ih testirali da bi utvrdili koliko ih je takođe pokupilo ljudski ACE2 gen i proizvelo protein humanog receptora.
„Oko 70% kolonija otpornih na antibiotike eksprimiralo je humani ACE2 protein na površini ćelije“, rekao je Freimuth. „Dalja analiza je pokazala da ove kolonije sadrže, u proseku, 28 kopija ljudskog ACE2 gena.
Važno je da su mišje ćelije držale „strane“ kopije ACE2 gena i nastavile da prave ljudski ACE2 protein koji su kodirali ovi geni tokom najmanje 90 generacija ćelija.
Nivo humanog ACE2 proteina proizvedenog u ćelijama bio je generalno proporcionalan broju kopija ACE2 gena integrisanih u genom miša. Nekoliko klonova mišjih ćelija proizvelo je oko 50 puta više ACE2 nego što je normalno prisutno na ćelijama miša.
Naučnici su koristili različite metode da testiraju da li su ljudski ACE2 proteini napravljeni od miša funkcionalni. To uključuje demonstraciju da se „pseudovirus“ koji sadrži COVID spike protein – to jest, nepatogena zamena za SARS-CoV-2 – može da se veže za receptore i inficira ćelije.
„Ovi testovi infektivnosti su pokazali da je ljudski ACE2 protein eksprimiran na ovim mišjim ćelijama potpuno funkcionalan“, rekao je Freimuth.
U međuvremenu, Oleg Gang i Feiiue Teng, koautori studije iz CFN-a, istražili su različite načine za stvaranje ekstracelularnih nano-vezikula obogaćenih ljudskim ACE2 mamcem za potencijalni tretman COVID-19. Oni takođe istražuju postavljanje ACE2 proteina na nanočestice za potencijalnu primenu u lečenju infekcija ili brzom otkrivanju virusa.
„Izazov koji predstavljaju nano-vezikule zasnovane na ACE2 leži u poboljšanju njihovog efekta neutralizacije protiv SARS-CoV-2. Takođe tražimo načine da poboljšamo i iskoristimo vezujuću osetljivost i specifičnost ACE2-sparenih nanočestica kako bismo ih učinili korisnim za viruse dijagnostika. Oba pristupa bi zahtevala buduće napore u optimizaciji“, rekao je Teng, naučni saradnik u CFN-u koji je intenzivno radio i na biološkim aspektima ove studije i na potencijalnim primenama zasnovanim na nanonauci.
„Uzbuđeni smo što kombinujemo napredak u proizvodnji nanomaterijala sa biomolekularnim pristupima za razvoj novih terapijskih i senzitivnih strategija“, rekao je Gang, koji ima zajednički sastanak na Univerzitetu Kolumbija. „Ova studija nam je omogućila da prevaziđemo neke metodološke probleme jer su nanomaterijali i biosistemi zahtevali sasvim različite pristupe karakterizaciji. Ono što smo ovde naučili važno je za naše sledeće korake u poboljšanju biosenzivanja zasnovanog na nanočesticama.“
Pored omogućavanja mogućih primena rekombinantnog ACE2 proteina, rad takođe pokazuje novi pristup za proizvodnju širokog spektra kompleksnih proteina. Primeri uključuju široku lepezu receptora na ćelijskoj površini koji posreduju u bezbroj bioloških procesa i procesa bolesti, kao i industrijski važnih proteina kao što su monoklonska antitela i enzimi.
„Naš metod korišćenja netaknutih gena zajedno sa ćelijama miša koje se mogu prilagoditi da rastu u ogromnim kulturama suspenzije – slično kao i kulture tečnog bujona koje se koriste za uzgoj bakterija – može unaprediti proizvodnju ovih i drugih važnih proteina velikih razmera“, rekao je Freimuth. .