RNK granule, mesta za skladištenje, transport i regulaciju molekula RNK unutar ćelija, transportuju se duž aksona, a zatim se prevode lokalno, daleko od tela ćelije. Nedavne studije sugerišu da ove granule mogu da se „izvuku“ iz vezikula povezanih sa lizozomima, struktura vezanih za membranu u ćelijama koje dele zajedničke karakteristike sa lizozomima.
Istraživači sa Nacionalnog instituta za zdravlje nedavno su krenuli da dalje istražuju transport RNK granula uz lizozomske vezikule, koristeći tehniku koja sprečava transport ovih vezikula.
Njihovi nalazi, objavljeni u Nature Neuroscience, potvrdili su da se velika grupa RNK glasnika transportuje u akson zajedno sa lizozomskim vezikulama, omogućavajući lokalno prevođenje dalje od some ili tela ćelije (tj. primarnog dela neurona).
„U prethodnim istraživanjima, naša laboratorija je identifikovala kompleks sa više podjedinica nazvan BORC, koji povezuje lizozome sa kinezinskim motorima, omogućavajući njihovo kretanje duž staza mikrotubula prema periferiji ćelije“, rekao je Huan Bonifacino, koautor rada, za Medical Kspress.
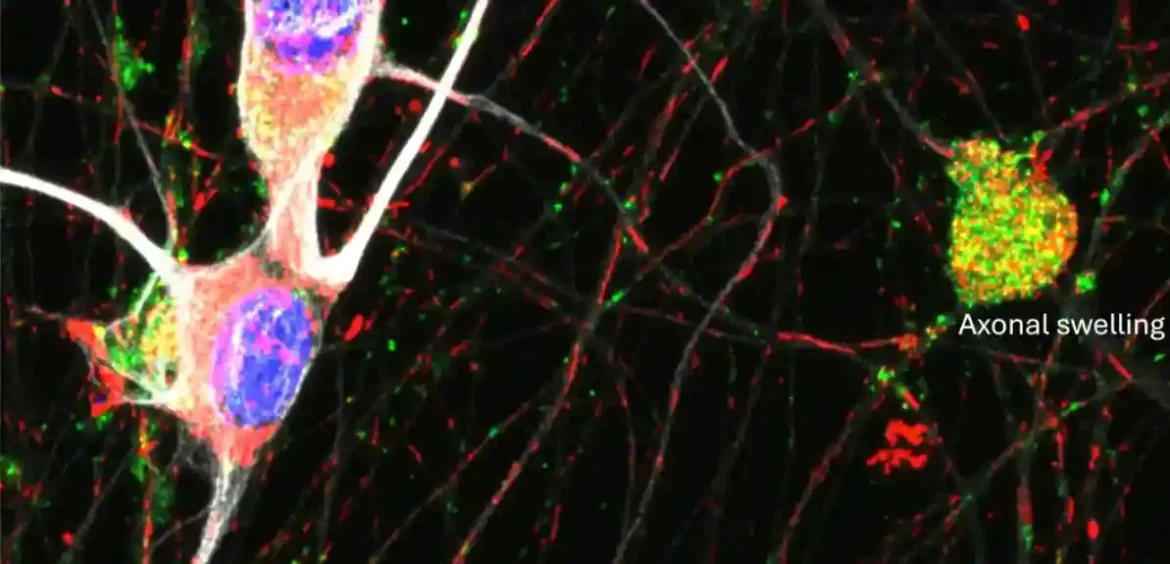
„U skladu sa ovom ulogom, mutacije u BORC podjedinicama i kod miševa i kod ljudi, ometaju transport lizozomskih vezikula od tela neurona do aksona. Ovaj poremećaj dovodi do aksonalne distrofije i degeneracije, što na kraju dovodi do ozbiljnih neuroloških oštećenja.“
Da bi sproveli svoje eksperimente, Bonifacino i njegovi saradnici su iskoristili sposobnost da zaustave transport lizozomalnih vezikula u aksone, izbacivanjem podjedinica BLOC-one povezanog kompleksa (BORC) otkrivenog u njihovim prethodnim studijama. Ova metoda im je na kraju omogućila da istraže mehanizam kroz koji nedostatak transporta lizozomskih vezikula ugrožava zdravlje aksona.
„Posebno smo bili zaintrigirani mogućnošću da BORC-podjedinica KO spreči aksonalni transport ne samo lizozomalnih vezikula već i granula RNK koje obično stopiraju na te vezikule, kao što su pokazale laboratorije naših kolega Michaela Varda (NINDS, NIH) i Jennifer Lippinkot-Švarc (HHMI-Janelija)“, rekao je Bonifačino.
Da bi testirali hipotezu da KO BORC podjedinica indirektno ometa transport nekih mRNK u aksone, istraživači su koristili razne napredne eksperimentalne tehnike. Prvo su koristili ljudske neurone izvedene iz indukovanih pluripotentnih matičnih ćelija (iPSC), kojima je lako manipulisati u laboratorijskim uslovima, da utišaju ili indukuju ekspresiju specifičnih gena.
Zatim su koristili novi mikrofluidni uređaj razvijen u Nacionalnom institutu za zdravlje, koji se može koristiti za izolovanje dovoljnih količina aksonskog materijala za obavljanje sekvenciranja RNK (RNA-Sek) i biohemijskih analiza. Konačno, oni su pratili transport specifičnih fluorescentno obeleženih mRNK koristeći tehnike snimanja uživo i koristili različite eksperimentalne metode da ispitaju i strukturu i funkciju mitohondrija.
„Naši eksperimenti su otkrili da se velika grupa mRNK transportuje u akson zajedno sa lizozomskim vezikulama, omogućavajući lokalni prevod dalje od some“, objasnio je Bonifacino. „Mesindžer RNK koji kodira mitohondrijalne i ribozomalne proteine posebno je zastupljen u ovoj kohorti.
„MRNK povezane sa mitohondrijama igraju ključnu ulogu u održavanju mitohondrijalne kondicije, uključujući održavanje integriteta sistema oksidativne fosforilacije i membranskog potencijala, i sprečavanje prekomerne mitofagije. Shodno tome, ovo održavanje doprinosi očuvanju zdravlja aksona. KBORC-subunit disrupt proces, što dovodi do aksonalne distrofije i degeneracije.“
Nedavna studija Bonifacina i njegovih saradnika pokazala je da transport mRNK na vezikule povezane sa lizozomima doprinosi održavanju aksonalne homeostaze i da kompromitovanje ovog transporta uzrokuje degeneraciju aksona.
Novootkriveni mehanizam aksonalne degeneracije u neuronima BORC-podjedinice-KO mogao bi biti povezan sa neurodegeneracijom povezanom sa različitim poremećajima, uključujući Alchajmerovu bolest i Parkinsonovu bolest, koji su oba povezana sa oštećenjima u mitohondrijskoj oksidativnoj fosforilaciji u nekoj fazi njihovog napredovanja.
„Sada planiramo da nastavimo naše studije o tome kako defekti u aksonskom transportu lizozomskih vezikula i mRNK doprinose patogenezi različitih razvojnih i neurodegenerativnih poremećaja“, dodao je Bonifacino. „Konkretno, sposobnost da se izoluju čisti aksoni pomoću naših mikrofluidnih uređaja omogućiće sveobuhvatnije analize sastava i funkcije aksona.“