Pre 10 godina videli smo iskorak u modernoj biologiji.
Američki naučnik je otkrio da je manipulacija proteinom Cas9 rezultirala genskom tehnologijom dostojnom naučno-fantastičnog filma: CRISPR.
Zamislite to kao par molekularnih makaza koje mogu da seku i uređuju DNK ljudi, životinja, biljaka, bakterija i virusa.
Potencijal je ogroman i pokriva sve, od brisanja naslednih bolesti do proizvodnje useva sposobnih da izdrže klimatske promene.
Međutim, kao i svaka druga nova tehnologija, CRISPR je imao svoje izazove. Jedan od glavnih izazova bio je da tehnologija bude što efikasnija i da se osigura da makaze seku samo tamo gde mi želimo.
„Opisali smo nove mehanizme iza CRISPR-a“
Dve nove studije sa Univerziteta u Kopenhagenu sprovedene zajedno sa istraživačima sa Univerziteta Arhus mogu pomoći u rešavanju ovih problema.
„Opisali smo nove mehanizme iza CRISPR-a“, kaže profesor bioinformatike Jan Gorodkin sa Odeljenja za veterinu i nauke o životinjama.
„Sada smo u mogućnosti da objasnimo zašto su neke nenamenske posekotine, a to su nenamerni rezovi na drugim mestima u genomu, efikasniji od onih na meti, a to je presek na predviđenom mestu. Takođe smo naučili kako različite DNK sekvence oko na -cilj može uticati na to koliko efikasno protein Cas9 seče DNK. Nadamo se da će ovo znanje utrti put za efikasniju i sigurniju upotrebu CRISPR-a.“
Dakle, kako funkcioniše CRISPR? Prvo, naučnik će dizajnirati komad sintetičke RNK nazvan RNK vodič. Ovo se zatim vezuje za protein Cas9 koji će obavljati zadatak sečenja DNK. Vodič za RNK traži odgovarajući odeljak DNK. Kada RNK vodič pronađe pravo mesto, Cas9 će preseći DNK niz. Sada je naučnik u stanju da ubaci bilo koji sintetički komad DNK na ispražnjeno mesto.
Ako Cas9 i vodeća RNK pogode metu, naučnici to smatraju da je na meti; ako pogode drugo mesto, nisu na meti.
Danas se CRISPR u kontekstu medicine uglavnom koristi za proučavanje kako geni i lekovi funkcionišu u laboratoriji i još uvek se ne koristi široko u lečenju ljudi. Međutim, dugoročno gledano, ideja je da se CRISPR koristi u lečenju određenih genetskih bolesti.
Rešena misterija efektivnih vanmeta
U jednoj od dve nove studije, istraživači su pokušali da odrede najbolji način da se RNK vodič pričvrsti za DNK, čineći rez što efikasnijim – jer ako rez nije dovoljno efikasan, naučnici neće moći da uredi DNK.
„Već znamo da CRISPR zapravo ne funkcioniše kada je veza između RNK vodiča i DNK preslaba. Sada smo naučili da je i previše jaka veza problematična“, kaže Gorodkin. „U oba slučaja, genske makaze su preslabe i neefikasne.
Istraživači su zatim identifikovali interval u kome veza između RNK vodiča i DNK nije ni prejaka ni preslaba, već tačna, što rezultira makazama sa savršenom oštrinom.
„Zanimljivo je da se ovo zapažanje takođe može koristiti da se objasni zašto neki izvan mete pokazuju jaču aktivnost CRISPR-a od njihovih predviđenih na meti – to jest, zašto su makaze oštrije za neke izvan mete nego za one na meti“, objašnjava Gorodkin .
„To je zato što suviše jake mete ne spadaju u pravi interval energije vezivanja. Ali ako uklonite deo energije iz ovih jakih veza, što se dešava na mestima van cilja, moći ćete da uđete u interval udesno, što rezultira snažnijim efektom, a samim tim i makazama za oblikovanje van mete.“
Studija je takođe identifikovala optimalnu poziciju proteina Cas9 za postizanje najefikasnijeg rezanja.
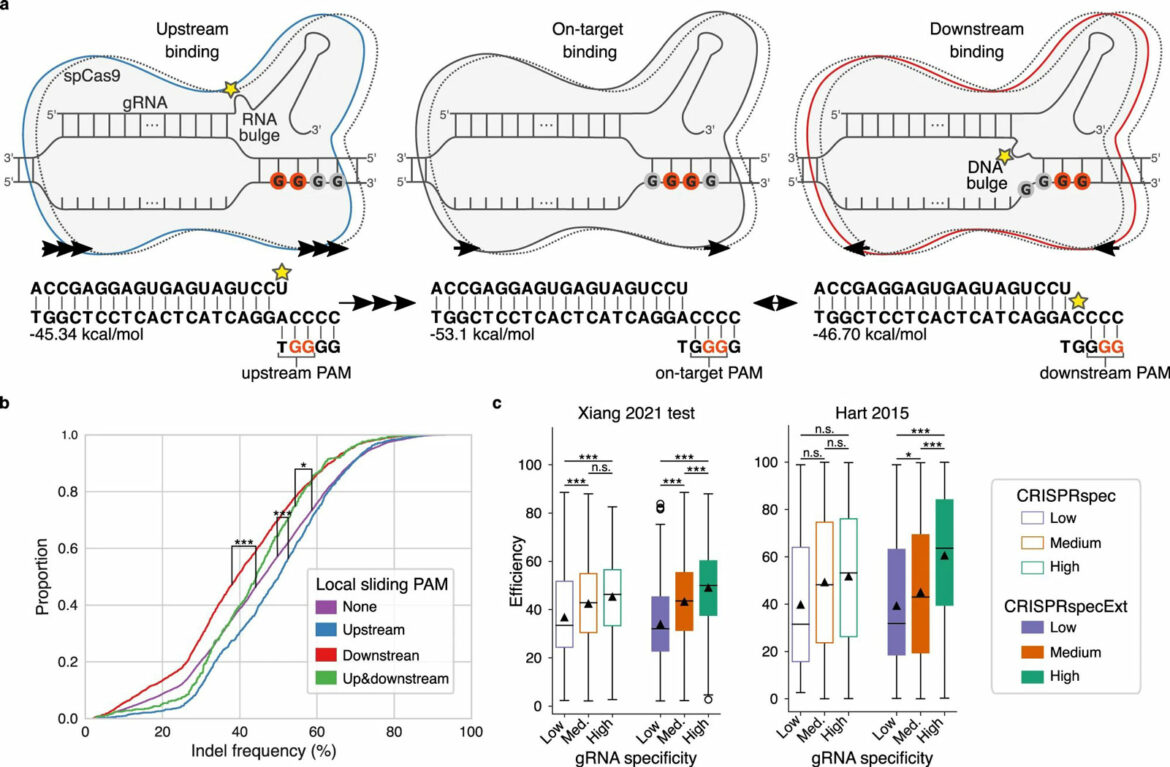
Pre nego što Cas9 bude u stanju da preseče DNK, protein se mora vezati za određeni deo DNK niza. DNK se sastoji od četiri različita nukleotida: A, C, G i T, a Cas9 se može vezati samo za sekvencu sa dva uzastopna G nukleotida.
Sada su istraživači identifikovali efekat više uzastopnih G nukleotida na Cas9 – situacija u kojoj je teško pogoditi metu jer se svaka dva uzastopna G takmiče za vezivanje sa Cas9.
„Kada postoji nekoliko G-ovih ‘uzvodno’, to jest pre sekvence za koju je Cas9 nameravao da se veže, rez će biti efikasniji. Ali kada postoji nekoliko G-ovih ‘nizvodno’, odnosno posle predviđene sekvence za Cas9 da se veže, rez je manje efikasan“, objašnjava postdok Giulia Corsi.
Corsi se nada da će nova saznanja o tome kako CRISPR funkcioniše olakšati identifikaciju tačne pozicije Cas9 u budućnosti. Ovo bi takođe trebalo da pomogne da se minimizira broj potencijalnih neželjenih efekata.
„Želeli bismo da možemo da predvidimo rez, poboljšamo uređivanje meta i eliminišemo nedostatke, koji komplikuju razvoj novih lekova zahtevajući mnogo resursa i mogu dovesti do neželjenih efekata koji se javljaju kada isečete pogrešan gen“, kaže Corsi.
Promašaji mogu biti štetni—i nedovoljno su istraženi
Druga studija se fokusira na izvan cilja. Ovde su istraživači razvili metod za merenje efikasnosti van ciljeva.
Da bi kontrolisali kvalitet CRISPR eksperimenta, naučnici obično biraju manji broj kompjuterski predviđenih promašaja za testiranje. Koristeći novu tehnologiju, međutim, moći će da testiraju mnogo veći broj izvan cilja, a očekuje se da će to ubrzati razvoj novih lekova sa manje neželjenih efekata.
Koristeći novu metodu, istraživači su testirali 8.000 potencijalnih izvan ciljeva za 110 CRISPR vodećih RNK u procesu prevođenja u ljudsku medicinu. Otkrili su da je oko 10 procenata od 8.000 potencijalnih izvan ciljeva u stvari bilo van cilja.
„Pronašli smo mnogo više vanmeta nego što bismo mogli da koristimo postojeće metode“, objašnjava Gorodkin.
Štaviše, 37 od ovih promašaja nalazi se u genima povezanim sa rakom, što povećava rizik da će razvoj lekova postati teži ili čak nemoguć. Pored toga, nenamerni rezovi u ovim genima mogu čak dovesti do raka kao moguće nuspojave.
„Istraživači moraju da budu u stanju da identifikuju takve vanciljeve i odaberu druge RNK za vodiče koje nemaju ove ili bilo koje druge kritične van mete“, kaže Gorodkin.
Velika potreba za dodatnim istraživanjima van ciljeva
Prema Gorodkinu, ovo pokazuje da postoji velika potreba za dodatnim istraživanjima van ciljeva.
„Tvrdio bih — a neki se možda i ne slažu — da su vanciljevi izuzetno nedovoljno istraženi. Moj utisak je da postojećim studijama o uređivanju gena često nedostaju kompletni alati i analize koje su potrebne da pokažu da u njihovim studijama nema efekata van cilja. ,“ on kaže.
Prema rečima Jana Gorodkina, nova metoda će imati veliki uticaj u budućnosti da se bolje provere da li studije nisu za cilj.
„U proteklih 10 godina napravili smo veliki korak ka tome da budemo u mogućnosti da uredimo genom. Sada smo u procesu da naše metode učinimo boljim, sigurnijim i efikasnijim. Ovo poslednje takođe podržava zelenu tranziciju, kao modifikacije genoma, na primer ćelija koje se koriste u proizvodnji, može dovesti do isplativijeg korišćenja resursa.“