Nova otkrića Stoversovog instituta za medicinska istraživanja otkrivaju kritične uvide o tome kako opasan sebični gen – koji se smatra parazitskim delom DNK – funkcioniše i preživljava. Razumevanje ove dinamike je dragocen resurs za širu zajednicu koja proučava mejotičke pogonske sisteme.
Nova studija, objavljena u PLoS Genetics 7. decembra 2022, otkriva kako sebični gen u kvascu koristi strategiju protiv otrova koja omogućava njegovu funkciju i verovatno je olakšala njegov dugoročni evolucioni uspeh. Ova strategija je važan dodatak za naučnike koji proučavaju slične sisteme, uključujući timove koji dizajniraju sintetičke pogonske sisteme za kontrolu patogenih štetočina. Kolektivni i zajednički napredak u razumevanju takvog pokreta može jednog dana dovesti do iskorenjivanja populacija štetočina koje štete usevima ili čak ljudima u slučaju bolesti koje se prenose vektorima.
„Prilično je opasno da genom kodira protein koji ima kapacitet da ubije organizam“, rekla je Sara Zanders, istraživač saradnik u Stoversu, dr. „Međutim, razumevanje biologije ovih sebičnih elemenata moglo bi nam pomoći da izgradimo sintetičke pokretače za modifikovanje prirodnih populacija.“
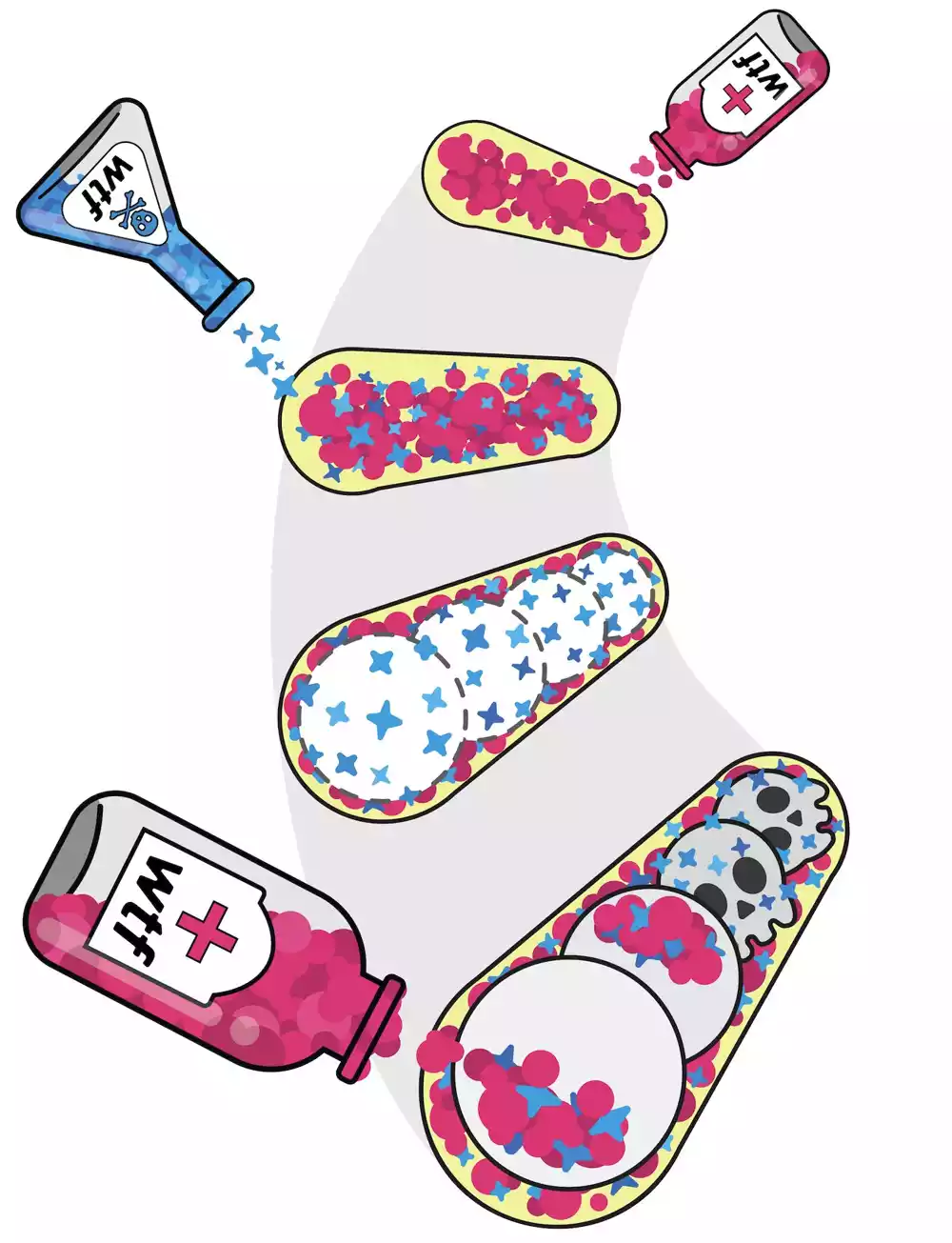
Pokretači su sebični geni koji se mogu širiti u populaciji većom brzinom od većine drugih gena, a da pritom ne budu od koristi organizmu. Prethodno istraživanje laboratorije Zanders otkrilo je da pokretački gen u kvascu, vtf4, proizvodi otrovni protein sposoban da uništi svo potomstvo. Međutim, za par hromozoma date roditeljske ćelije, pogon se postiže kada se vtf4 nađe samo na jednom hromozomu. Efekat je istovremeno spasavanje samo onih potomaka koji nasleđuju pogonski alel, isporukom doze veoma sličnog proteina koji se suprotstavlja otrovu, antidotu.
Nadovezujući se na ovaj rad, studija, koju je vodila bivša predoktorska istraživačica dr Nikol Nukols, i sadašnja predoktorska istraživačica Ananja Nidamangala Srinivasa u Zanders laboratoriji, otkrila je da su razlike u vremenu stvaranja otrova i proteina antidota iz vtf4 i njihovih jedinstvenih obrasci distribucije unutar spora u razvoju su fundamentalni za pogonski proces.
Tim je razvio model koji nastavlja da istražuje kako otrov deluje da ubije sporu – ekvivalent ljudskom jajetu ili spermi u kvascu. Njihovi rezultati pokazuju da se otrovni proteini grupišu, potencijalno ometajući pravilno savijanje drugih proteina potrebnih za funkcionisanje ćelije. Pošto gen vtf4 kodira i otrov i antidot, antidot je veoma sličan po obliku i grupiše se zajedno sa otrovom. Međutim, antidot ima dodatni deo koji izgleda da izoluje klastere otrova-antidota tako što ih dovodi u ćelijsku kantu za smeće, vakuolu.
Da bi razumeli kako sebični geni funkcionišu tokom reprodukcije, istraživači su pogledali početak formiranja spora i pronašli otrovni protein izražen u svim sporama u razvoju i kesici koja ih okružuje, dok je protein antidota primećen samo u niskoj koncentraciji u celoj kesici. Kasnije u razvoju, antidot je obogaćen unutar spora koje su nasledile vtf4 iz roditeljske ćelije kvasca.
Istraživači su otkrili da spore koje su nasledile gen pokretača proizvode dodatni antidot protein unutar spore da neutrališu otrov i osiguraju njihov opstanak.
Tim je takođe otkrio da određeni molekularni prekidač koji kontroliše mnoge druge gene uključene u formiranje spora takođe kontroliše ekspresiju otrova, ali ne i antidota, iz gena vtf4. Prekidač je od suštinskog značaja za reprodukciju kvasca i neraskidivo je povezan sa vtf4, pomažući da se objasni zašto je ovaj sebični gen tako uspešan u izbegavanju bilo kakvih pokušaja domaćina da onemogući prekidač.
„Jedan od razloga zašto mislimo da su se ove stvari tako dugo zadržale — oni su koristili ovu podmuklu strategiju iskorišćavanja istog suštinskog prekidača koji uključuje reprodukciju kvasca“, rekao je Nidamangala Srinivasa.
„Ako bismo mogli da manipulišemo ovim DNK parazitima da se eksprimiraju u komarcima i podstičemo njihovo uništenje, to bi mogao biti način za kontrolu vrsta štetočina“, rekao je Nuckolls.