Spektar neurodegenerativnih bolesti, uključujući frontotemporalnu demenciju (FTD), progresivnu supranuklearnu paralizu (PSP) i kortikobazalnu degeneraciju (CBD) nastaje zbog akumulacije abnormalnih, pogrešno savijenih tau proteina u mozgu. Tim istraživača predvođen naučnicima UC Santa Barbara pronašao je potencijalne načine da prekine ovaj proces ciljanjem na „lepljiva“ mesta duž dugog oblika mutiranog taua, sprečavajući pogrešno savijanje i širenje neurofibrilarnih zapleta.
„Ovo je prava saradnja biologije i hemije“, rekao je neuronaučnik UCSB-a Kenet S. Kosik, koji sa profesorima hemije Songi Hanom, Džoan-Emom Ši i profesorom hemijskog inženjerstva Skotom Šelom, predstavlja nalaze u časopisu PNAS.
Studija predstavlja uvide na molekularnom nivou o načinu na koji se patološki tau širi, a prema istraživačima, ovo razumevanje bi moglo dovesti do „terapijske intervencije koja je potencijalno sposobna da razdvoji tau ili spreči njegovu agregaciju“ u dugom obliku akumulacije taua.
Tau je esencijalni strukturni protein u mozgu, daje ćelijama formu i stabilnost i omogućava transport neophodnih hranljivih materija. Međutim, kada mutira i pogrešno se savija, može se zalepiti i zapetljati. Štaviše, ova greška u savijanju može postati šablon za pogrešna uputstva koja usmeravaju normalne tau proteine da se pogrešno savijaju i sakupljaju sve dok se stanje ne proširi na široke delove mozga, ometajući funkcije mozga. Specifične lokacije na kojima se ovi neurofibrilarni spletovi javljaju u mozgu razlikuju se među neurodegenerativnim poremećajima.
Postoje dva posebna oblika tau, koji služe kao polazna tačka za ovu kategoriju neurodegenerativnih bolesti, nazvanih tauopatije, i po kojima je Alchajmerova bolest najpoznatija. Tau se proizvodi u kratkoj verziji sa tri ponavljanja i dužoj verziji sa četiri ponavljanja; ovo drugo u fokusu ovog istraživanja.
Tauopatije koje su daleko manje uobičajene od Alchajmerove bolesti, kao što su FTD, PSP i CBD, su isključivo tauopatije tipa 4R, iako neurodegenerativne bolesti takođe mogu biti povezane sa 3R oblikom, ili, kao u slučaju Alchajmerove bolesti, kombinacijom oba. Otkrića u ovom istraživanju odnose se na bolesti koje akumuliraju 4R tau.
Spajanjem naprednih tehnika kao što su transmisiona elektronska mikroskopija i simulacije molekularne dinamike sa in-vitro eksperimentima koji uključuju ćelijske kulture, istraživački tim je uspeo da stekne osećaj pod kojim patološki 4R tau počinje da se pogrešno savija, oblikuje druge tau proteine i agregira.
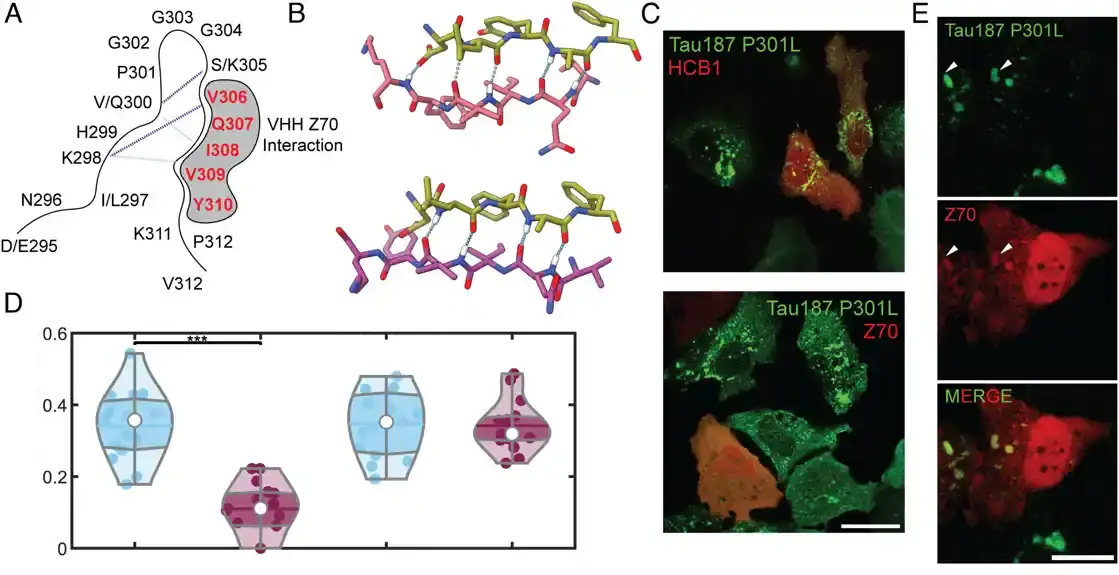
„Tau se savija na jedinstven način u svakoj od ovih bolesti“, objasnio je Kosik. „Jedan deo se savija u strukturu ukosnice samo u 4R tau.“ Unutar ukosnice, objasnio je on, nalazi se lepljivi segment nazvan PHF6 koji može da veže i složi druge tau proteine u velike agregacije.
Ali šta ako je moguće izazvati tau agregaciju u ćelijskoj kulturi i koristiti sistem da ometa ovo lepljivo mesto? „Stvaranje uslova za tau propagaciju služi kao sistem visoke propusnosti za otkrivanje jedinjenja koja mogu ometati tau agregaciju“, prokomentarisao je Kosik.
Otkrili su, na primer, da je jedna zamena amino kiseline duž proteina pored lepljivog regiona bila dovoljna da spreči tau agregaciju slabljenjem pristupa ranjivom delu peptida.
U drugim istraživanjima, istraživači su takođe otkrili da su nanotela – fragmenti antitela – sintetizovana iz krvi kamila (kamila, lama i drugih članova porodice Camelidae) bila u stanju da se vežu za region PHF6, inhibirajući agregaciju taua. Bez obzira na terapiju, region koji obuhvata segment ukosnice 4R tau je očigledno aktivna zona za ciljanje.
Istraživači još uvek imaju dug put pre nego što se ciljani terapeutici mogu razviti i odobriti da inhibiraju formiranje neurofibrilarnih čvorova koji karakterišu tauopatije. Ali nalazi u ovom radu otkrivaju uzbudljive potencijalne puteve za zaustavljanje kritičnih koraka ka akumulaciji mutantnog taua.
„Želeli bismo da nastavimo da testiramo ovu tehnologiju na životinjskim modelima“, rekao je Kosik, odajući priznanje postdoktorskom istraživaču i vodećem autoru Endru Longhiniju za njegov „ogromni doprinos“ idejama i eksperimentima. Što se tiče hemije, rad istraživača diplomiranih studenata Ostina DeBozea i Semjuela Loboa u projektovanju interakcija proteina i obavljanju računarskih teških dizanja takođe je bio od suštinskog značaja za projekat, rekao je on.
„To je tako interdisciplinarno, to je neverovatno“, rekao je Kosik. „Toliko sam naučio iz ovog projekta.“ Pored unapređenja istraživanja o nekim oblicima neurodegenerativnih bolesti, ovi nalazi mogu poslužiti kao polazna tačka za potencijalne tragove ka terapijama za 3R Pikovu bolest i za složeniju Alchajmerovu bolest.“