Kardiovaskularne bolesti, kao što su srčani udari, vodeći su uzrok smrti širom sveta kao rezultat ograničene moći samoizlečenja srca. Za razliku od ljudi, zebra ima izuzetnu sposobnost da se oporavi od srčanog oštećenja. Istraživači iz grupe Jeroen Bakkers (Hubrecht institut) su koristili zebricu da rasvetle njihov regenerativni uspeh. Otkrili su novi mehanizam koji funkcioniše kao prekidač za guranje ćelija srčanog mišića da sazrevaju u procesu regeneracije. Važno je da je ovaj mehanizam evolutivno očuvan jer je imao veoma sličan efekat na ćelije srčanog mišića miša i čoveka.
Rezultati studije, objavljeni u časopisu Science 18. maja, pokazuju da bi ispitivanje prirodnog procesa regeneracije srca kod zebrice i primena ovih otkrića na ćelije ljudskog srčanog mišića moglo doprineti razvoju novih terapija protiv kardiovaskularnih bolesti.
Procenjuje se da 18 miliona ljudi umre od kardiovaskularnih bolesti svake godine. Mnogi od ovih smrti su povezani sa srčanim udarima. U takvom slučaju, krvni ugrušak sprečava snabdevanje delova srca hranljivim materijama i kiseonikom. Kao rezultat, ćelije srčanog mišića u opstruiranom delu srca umiru, što na kraju dovodi do srčane insuficijencije. Iako postoje terapije koje upravljaju simptomima, ne postoji tretman koji bi mogao da zameni izgubljeno tkivo funkcionalnim, zrelim ćelijama srčanog mišića i na taj način izleči pacijente.
Za razliku od ljudi, neke vrste poput zebrica mogu da regenerišu svoja srca. U roku od 90 dana nakon oštećenja, potpuno obnavljaju svoju srčanu funkciju. Preživele ćelije srčanog mišića su u stanju da se podele i proizvode više ćelija. Ova jedinstvena karakteristika obezbeđuje srcima zebrice izvor novog tkiva koje će zameniti izgubljene ćelije srčanog mišića. Prethodne studije su uspešno identifikovale faktore koji bi mogli da stimulišu ćelije srčanog mišića da se podele. Ipak, šta se kasnije dešava sa novoformiranim ćelijama srčanog mišića ranije nije proučavano.
Phong Nguien, prvi autor studije, objašnjava: „Nejasno je kako ove ćelije prestaju da se dele i dovoljno sazrevaju da mogu da doprinesu normalnoj funkciji srca. Bili smo zbunjeni činjenicom da je u srcima zebrice novoformirano tkivo prirodno sazrelo i integrisana u postojeće srčano tkivo bez ikakvih problema.“
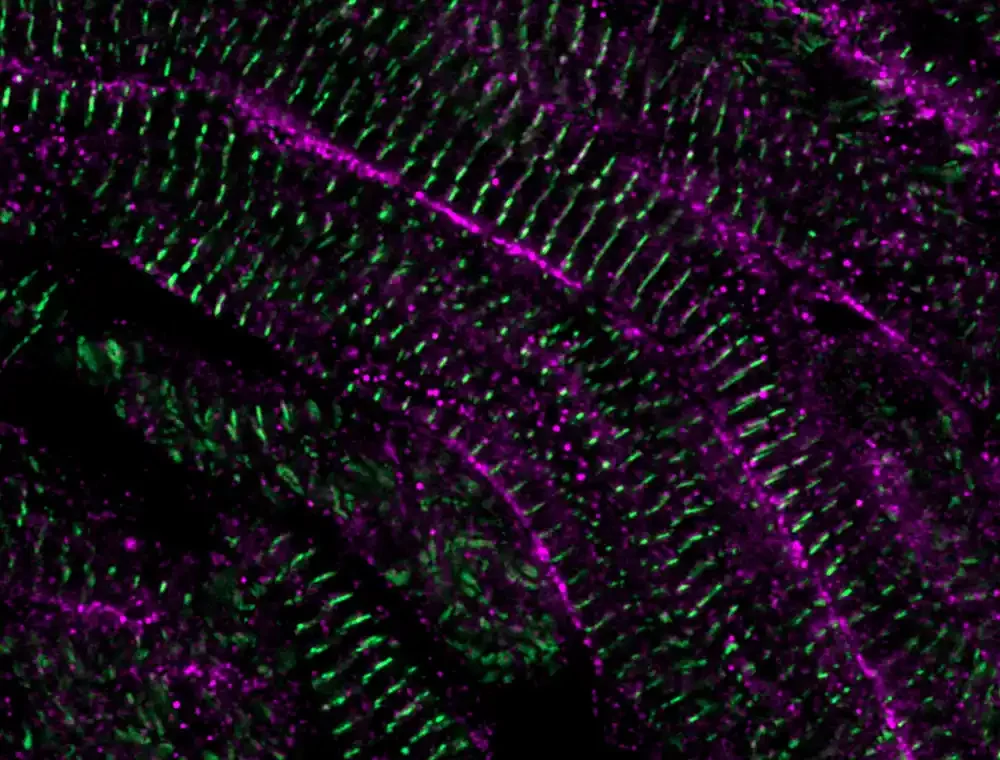
Da bi detaljno proučili sazrevanje novoformiranog tkiva, istraživači su razvili tehniku za koju su debele kriške povređenih srca zebrice uzgajane van tela. To im je omogućilo da izvode živo snimanje kretanja kalcijuma u ćelijama srčanog mišića. Regulacija kretanja kalcijuma u i iz ćelija srčanog mišića je važna za kontrolu srčanih kontrakcija i može predvideti zrelost ćelije. Tim je otkrio da nakon što se ćelije srčanog mišića podele, kretanje kalcijuma se vremenom menja.
„Pokret kalcijuma u novopodeljenoj ćeliji je u početku bio veoma sličan ćelijama embrionalnog srčanog mišića, ali su vremenom ćelije srčanog mišića poprimile zreli tip kretanja kalcijuma. Otkrili smo da srčana dijada, struktura koja je pomogla da se kalcijum pomera unutar ćelija srčanog mišića, a posebno jedna od njenih komponenti, LRRC10, bila je ključna u odlučivanju da li se ćelije srčanog mišića dele ili napreduju kroz sazrevanje. Ćelije srčanog mišića kojima nedostaje LRRC10 nastavile su da se dele i ostale su nezrele“, kaže Ngujen. Živo snimanje kretanja kalcijuma kroz ćelije srčanog mišića zebrice 21 dan nakon povrede.
Nakon što su Ngujen i njegove kolege ustanovili važnost LRRC10 u zaustavljanju deobe ćelija i pokretanju sazrevanja ćelija srčanog mišića zebrice, prešli su na testiranje da li se njihovi nalazi mogu prevesti na sisare. U tom cilju, oni su indukovali ekspresiju LRRC10 u mišjim i laboratorijskim ćelijama ljudskog srčanog mišića.
Zapanjujuće, LRRC10 je promenio rukovanje kalcijumom, smanjio deobu ćelija i povećao sazrevanje ovih ćelija na sličan način kao što je primećeno u srcima zebrice. Ngujen kaže: „Bilo je uzbudljivo videti da se lekcije naučene od zebrice mogu prevesti jer ovo otvara nove mogućnosti za upotrebu LRRC10 u kontekstu novih terapija za pacijente.
Rezultati studije, objavljeni u časopisu Science, pokazuju da LRRC10 ima potencijal da dalje pokreće sazrevanje ćelija srčanog mišića kroz kontrolu njihovog rukovanja kalcijumom. Ovo bi moglo pomoći naučnicima koji pokušavaju da reše nedostatak regenerativnog kapaciteta srca sisara presađivanjem ćelija srčanog mišića uzgojenih u laboratoriji u oštećeno srce. Iako je ova potencijalna terapija obećavajuća, rezultati su pokazali da su ove ćelije uzgojene u laboratoriji još uvek nezrele i ne mogu pravilno da komuniciraju sa ostatkom srca, što dovodi do abnormalnih kontrakcija zvanih aritmije.
„Iako je potrebno više istraživanja da bi se precizno definisalo koliko su zrele ove ćelije srčanog mišića uzgojene u laboratoriji kada se leče sa LRRC10, moguće je da će povećanje sazrevanja poboljšati njihovu integraciju nakon transplantacije“, kaže Jeroen Bakkers, poslednji autor studije.
„Pored toga, trenutni modeli srčanih bolesti se često zasnivaju na nezrelim ćelijama srčanog mišića uzgojenim u laboratoriji. 90% obećavajućih kandidata za lekove koji se nalaze u laboratoriji ne uspevaju da dođu do klinike, a nezrelost ovih ćelija može biti jedan od faktora koji doprinose ovome. niska stopa uspeha. Naši rezultati pokazuju da bi LRRC10 takođe mogao da poboljša relevantnost ovih modela.“
LRRC10 bi stoga mogao imati važan doprinos u stvaranju ćelija srčanog mišića uzgojenih u laboratoriji koje preciznije predstavljaju tipično srce odrasle osobe, čime bi se poboljšale šanse za razvoj uspešnih novih tretmana protiv kardiovaskularnih bolesti.