Gregori i Debora Makres iz Kalifornije izgubili su sina Gregorija 1997. godine, kada je imao samo 4 godine. Mali Gregori je imao težak oblik retkog genetskog poremećaja zvanog Gošeova bolest i umro je posle neuspešnog eksperimentalnog lečenja.
Uprkos ličnom gubitku, Macresesovi nisu odustali od nastojanja da pronađu lek za bolest, osnivajući dobrotvornu fondaciju za podršku istraživanja u nekoliko laboratorija širom sveta, uključujući i onu prof. Institut za nauku.
Sada, nakon 25 godina istraživanja, naučnici Veizman-a predstavljaju inovativni genetski tretman koji je pokazao obećavajuće rezultate kod miševa, uključujući dramatično povećanje životnog veka i očuvanje motoričke funkcije. Studija je objavljena u časopisu Genska terapija.
Gošeova bolest je uzrokovana naslednim defektom enzima koji telo koristi da razgradi masnu supstancu zvanu glukocerebrozid. Kada se ova supstanca ne razgradi, ona se akumulira u ćelijskim „reciklažnim kantama“, zvanim lizozomi – gde se molekuli koji su završili svoj životni ciklus razlažu na svoje sastavne delove – uzrokujući oštećenja koja mogu biti fatalna.
Bolest je relativno češća među Jevrejima Aškenaza, koji obično imaju najneozbiljniji tip — Gošeov tip I — koji ne dovodi do oštećenja mozga. Druge dve varijante bolesti su mnogo teže: Gaucher tip II izaziva ozbiljno oštećenje mozga, sa brzim pogoršanjem simptoma i smrću pre 2 godine, dok se kod osoba sa tipom III fatalno oštećenje mozga javlja kasnije u detinjstvu ili čak u odrasloj dobi. .
Danas prihvaćeni tretman za Gošeovu bolest su ponovljene injekcije neoštećenog enzima da bi se smanjila akumulacija glukocerebrozida u telesnim tkivima. Ovaj tretman, međutim, ne leči bolest, niti pomaže kod težih vrsta Gošeove bolesti koje oštećuju mozak.
To je zbog krvno-moždane barijere, gustog sloja ćelija koje okružuju krvne sudove u mozgu i sprečavaju velike molekule, kao što je enzim koji se ubrizgava, da stignu do cilja.
Shodno tome, teže pogođeni pacijenti još uvek nemaju održiv tretman. Poslednjih godina, nekoliko istraživačkih grupa se fokusiralo na gensku terapiju, inovativni tretman u kome se normalna kopija defektnog gena ubacuje u ćelije, koristeći virus.
Ali umetanje normalne kopije defektnog gena ne mora nužno da nadoknadi genetski defekt. U nastojanju da ovo prevaziđu, istraživači iz laboratorije prof. Futermana sarađivali su sa kolegama iz laboratorije prof. Sarela Fleishmana, koja je specijalizovana za korišćenje kompjuterskih modela za dizajniranje i poboljšanje enzima.
Koristeći napredni algoritam koji su kreirali, naučnici u Fleishmanovoj laboratoriji dizajnirali su verziju gena koja ne samo da će nositi pravi recept za enzim, već će imati i poboljšani recept koji vodi do posebno aktivne i stabilne verzije sposobne da kompenzuje genetski defekt i suzbijanje akumulacije glukocerebrozida.
Nakon što su genetski konstruisali gen, naučnici predvođeni dr Ivanom Milenkovićem i dr Šani Blumenrajh iz Futermanove grupe ubrizgali su ga u mozak mladih miševa sa poremećajem koji oponaša Gaucher tip III, težak i neizlečiv oblik bolesti. Istraživači su pratili stanje mladunaca miša nakon tretmana merenjem njihove telesne težine i procenom njihove motoričke funkcije.
Naučnici su bili zapanjeni kada su otkrili da je, poput potpuno zdravih miševa, većina obolelih miševa lečenih projektovanim genom dobila na težini i živela znatno duže. Štenci su takođe održavali motoričku funkciju i ravnotežu, a neki su čak dostigli i potpuno normalan nivo.
Miševi koji su ostali nelečeni ili su dobili prirodnu verziju gena izgubili su do 20% svoje telesne težine u prva četiri meseca eksperimenta, a njihova motorna funkcija se pogoršavala kako je bolest napredovala.
Zatim su istraživači pokušali da shvate zašto je tretman bio tako efikasan. Oni su analizirali uzorke iz mozga miša i videli da tretman sa projektovanim genom značajno smanjuje akumulaciju glukocerebrozida u mozgu, dok prirodna verzija gena nije.
„Pretpostavljamo da mu poboljšana stabilnost enzima omogućava da izbegne razgradnju u ćeliji – on preživljava i obavlja svoj vitalni posao“, objašnjava Futerman.
Jedan posebno važan nalaz je da je ovaj tretman smanjio upalu mozga. 2015. godine, istraživači iz Futermanove laboratorije otkrili su da se određeni inflamatorni protein eksprimuje na visokim nivoima u mozgu ljudi sa Gošeovim tipom II i III, i da postoji korelacija između nivoa ekspresije gena i težine bolesti.
Iz ovoga su shvatili da zapaljenje igra ključnu ulogu u oštećenju mozga i da je gen marker za progresiju bolesti.
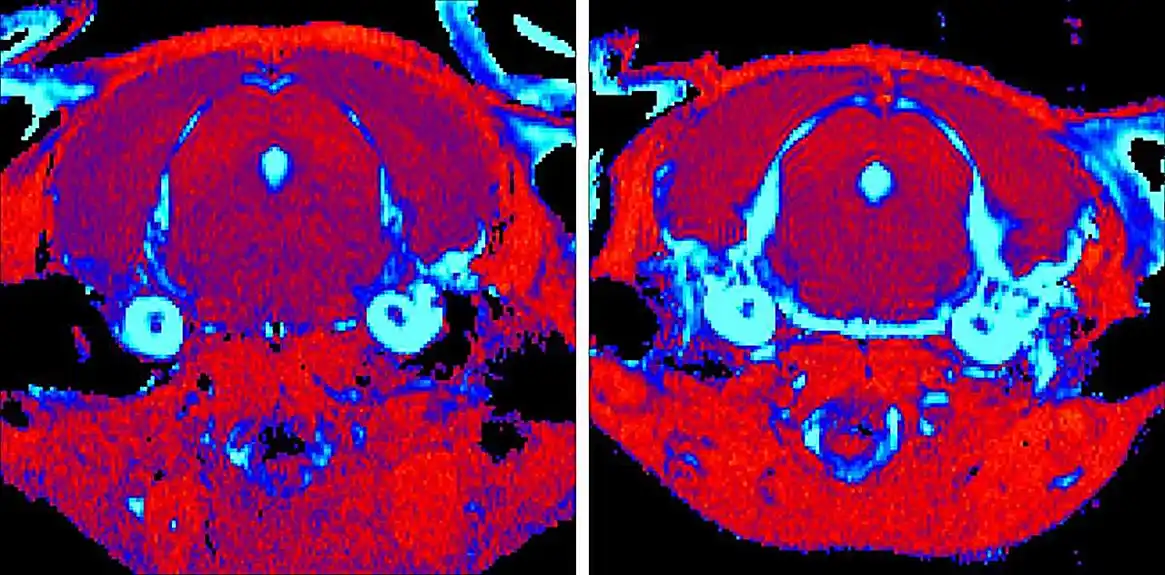
U svojoj novoj studiji, otkrili su da je nivo ekspresije i ovog markera i dva dodatna inflamatorna gena opao kod miševa koji su primili novi tretman. Ovi nalazi su potvrđeni MR skeniranjem, koji je pokazao smanjenje inflamatornih markera u mozgu.
„Četvrt veka porodica Macres prati moja istraživanja i ja sam ih ažurirao o svakom razvoju. Inovativna genska terapija za verziju Gošeove bolesti koja je odnela njihovog sina Gregorija za mene je neka vrsta zatvaranja, “, kaže Futerman.
„Nadamo se da ćemo pronaći partnere koji će nam pomoći da napredujemo u ovom inovativnom tretmanu — od opsežnijeg eksperimenta do kliničkih ispitivanja na ljudima. Postoji veliko interesovanje za ovo istraživanje osim Gošeove bolesti, što je relativno retko, jer studije pokazuju da defekti gen takođe povećava rizik od Parkinsonove bolesti.“