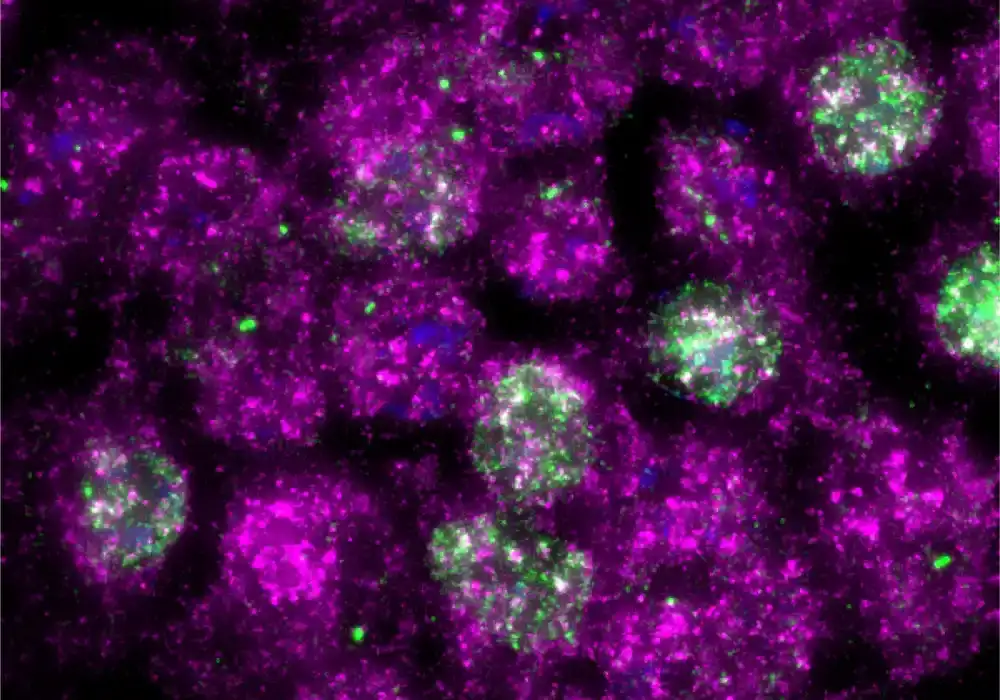
U nedavnoj studiji, istraživači iz Johns Hopkins Medicine sugerišu da ćelijska RNK (mRNA) – glavni prevodilac i regulator genetskog materijala – zajedno sa kritičnim proteinom zvanim ZAK – podstiče početni odgovor ćelije na oštećenje UV zračenja i igra ključnu ulogu ulogu u tome da li ćelija živi ili umire.
Iako je odavno poznato da UV zračenje oštećuje DNK, ono takođe oštećuje iRNK, a najnovija otkrića, objavljena u Cell , ukazuju da mRNK deluju kao prvi reagujući kada ćelijama govore kako da upravljaju stresom.
„RNA je kanarinac u rudniku uglja. Ona govori ćeliji: ‘Ovde imamo veliku štetu i moramo nešto da uradimo'“, kaže Rejčel Grin, dr, ugledni profesor molekularne biologije i genetike Blumberga i Daniel Nathans, direktor Odeljenja za molekularnu biologiju i genetiku na Medicinskom fakultetu Univerziteta Džon Hopkins. Grin, takođe istraživač na Medicinskom institutu Hauard Hjuz, je odgovarajući autor nove studije.
ZAK je ključni igrač u procesu koji identifikuje ćelijsko oštećenje tako što oseća sudare ribozoma, sićušnih makromolekularnih mašina koje pomažu RNK da prevede jezik gena u jezik proteina. Do sudara dolazi kada se ribozomi kreću duž mRNK oštećene UV zračenjem i, nesposobni da dekodiraju oštećenu poruku, uzrokuju da ribozomi u zastoju dobiju „zadnji kraj“ uzvodnim ribozomima. Sudari ribosoma aktiviraju ZAK, koji pokreće ćelijski signalni program poznat kao odgovor na ribotoksični stres. ZAK tada podstiče kaskadu nizvodnih događaja koji odlučuju o sudbini ćelije.
Sveobuhvatnije razumevanje načina na koji se odluke o životu i smrti donose nakon susreta sa UV zračenjem moglo bi pomoći istraživačima da razumeju osnovne uzroke raka kože i drugih karcinoma, kaže dr Niladri Sinha, postdoktorski saradnik Džejn Kofin Čajlds Memorijalnog fonda na Džons Hopkins Medicinski fakultet. Kompanije koje razvijaju lekove koji ciljaju na ribozome takođe mogu otkriti da ZAK može biti pokretač ćelijske smrti kod različitih tipova raka, kaže on.
Nalazi pokazuju da ZAK oseća obim ćelijskog oštećenja i reaguje u zavisnosti od toga koliko UV zračenja ćelija prima, nudeći nijansiranije razumevanje ćelijske smrti izazvane UV zračenjem i identifikujući nove načine da se ZAK aktivnost drži pod kontrolom, kaže Grin.
„Postoje načini na koje ZAK odgovara; nije sve ili ništa“, kaže ona.
Istraživanje takođe „veoma jasno pokazuje“ da je, na primer, sudbina ćelije kože neposredno posle UV zračenja „pre svega vođena obimom sudaranja ribozoma i ZAK signalizacije“, kaže Grin.
„U ovom režimu, oštećenje DNK i dobro okarakterisan put odgovora na oštećenje DNK, uključujući ključni protein p53, ne određuju značajno odluke o sudbini ćelije“, kaže ona.
Popravka oštećenja DNK je kritična i dešava se u podskupini ćelija koje kopiraju svoj genetski materijal, ali ovi putevi nisu glavni „odlučujući“ sudbine ćelije, kaže ona.
Grin je zajedno sa Dr Sergijem Regotom, vanrednim profesorom molekularne biologije i genetike na Medicinskom fakultetu Univerziteta Džons Hopkins, i dr Albanom Orduroom, pomoćnim članom Programa za biologiju ćelije u Memorijal Slounu, vodio istraživanje. Kettering Cancer Center Institute Sloan Kettering i docent na Veill Cornell.
Da bi sproveli svoje istraživanje, naučnici su izložili ljudske modele ćelija UV lampi koja oponaša sunčevo zračenje. Koristeći proteomiku za razumevanje ćelijske signalizacije u pristupu koji je vodio Ordureau, oni su procenili ulogu ZAK-a i napravili predviđanja o tome kako će ćelije reagovati na različite nivoe stresa. Odatle, eksperimenti slikanja živih ćelija koje je vodio Regot, pored interne biohemije ribozoma – radnog konja Grinove laboratorije – pomogli su da se okarakteriše kako je ćelijska smrt regulisana kao posledica UV zračenja posredovanog ZAK-om.
U budućnosti, istraživači planiraju da istraže tipove ćelija sa različitim režimima sinteze proteina, uključujući one kod melanoma i drugih karcinoma. Istraživači sumnjaju da će se brzorastuće ćelije oslanjati na regulaciju posredovanu ZAK-om više od drugih, kaže Grin.