Multipla skleroza (MS) degradira zaštitnu izolaciju oko nervnih ćelija, ostavljajući njihove aksone, koji nose električne impulse, izložene poput golih žica. Ovo može izazvati razorne probleme sa kretanjem, ravnotežom i vidom; a bez lečenja može dovesti do paralize, gubitka nezavisnosti i skraćenog životnog veka.
Sada su naučnici sa UC San Francisco i Contineum Therapeutics razvili lek koji podstiče telo da zameni izgubljenu izolaciju, koja se zove mijelin. Ako deluje kod ljudi, to bi mogao biti način da se preokrene šteta uzrokovana bolešću.
Nova terapija, nazvana PIPE-307, cilja na neuhvatljivi receptor na određenim ćelijama u mozgu koji ih podstiče da sazrevaju u oligodendrocite koji proizvode mijelin. Jednom kada je receptor blokiran, oligodendrociti počinju da deluju, omotavajući se oko aksona da bi formirali novu mijelinsku ovojnicu.
Bilo je ključno dokazati da je receptor, poznat kao M1R, prisutan na ćelijama koje mogu da poprave oštećena vlakna. Naučnik iz Contineuma i prvi autor dr Majkl Pun je ovo otkrio koristeći toksin koji se nalazi u zmijskom otrovu zelene mambe.
Rad, koji se pojavljuje 2. avgusta u časopisu PNAS, obuhvata deceniju rada naučnika UCSF Džona Čena, dr. i Arija Grina, dr. Čen je naveo tim da otkrije 2014. da opskurni antihistaminik poznat kao klemastin može da izazove remijelinizaciju, za koju niko nije znao da je moguća.
„Pre deset godina otkrili smo jedan način na koji telo može da regeneriše svoj mijelin kao odgovor na pravi molekularni signal, vraćajući posledice MS“, rekao je Čen, uvaženi profesor neurologije Debi i Endi Rejlef na UCSF-u i stariji autor knjige papir. „Pažljivim proučavanjem biologije remijelinacije, razvili smo preciznu terapiju za njeno aktiviranje – prvu u novoj klasi terapija MS.“
Prvobitno otkriće došlo je kada je Chan izmislio metod za skrining lekova na njihovu sposobnost da podstaknu remijelinizaciju. Ekran je identifikovao grupu lekova, uključujući klemastin, koji su imali jednu zajedničku stvar: blokirali su muskarinske receptore.
Prednosti klemastina počinju njegovim dejstvom na ćelije prekursora oligodendrocita (OPC). Ove ćelije ostaju u stanju mirovanja u mozgu i kičmenoj moždini sve dok ne osete povređeno tkivo. Zatim se useljavaju i stvaraju oligodendrocite, koji proizvode mijelin.
Iz nekog razloga, tokom MS, OPC se okupljaju oko raspadajućeg mijelina, ali ne uspevaju da ga ponovo izgrade. Chan je shvatio da je klemastin aktivirao OPC blokirajući muskarinske receptore, omogućavajući OPC da sazre u oligodendrocite koji proizvode mijelin.
Nerve i njihov mijelin je poznato da je teško popraviti, bilo zbog MS, demencije ili drugih povreda. Grin i Čen su sproveli ispitivanje klemastina kod pacijenata sa MS, i to je bio uspeh – prvi put da je lek pokazao sposobnost da obnovi mijelin izgubljen u MS. Međutim, uprkos tome što je bio bezbedan za upotrebu, klemastin je bio samo skromno efikasan.
„Klemastin nije ciljani lek, koji utiče na nekoliko različitih puteva u telu“, rekao je Grin, šef odeljenja za neuroimunologiju i glijalnu biologiju na Odeljenju za neurologiju UCSF-a i koautor rada. „Ali od samog početka, videli smo da bi njegova farmakologija sa muskarinskim receptorima mogla da nas usmeri ka sledećoj generaciji restorativnih terapija u MS.“
Istraživači su nastavili da koriste klemastin da bi razumeli kurativni potencijal regeneracije mijelina u MS. Oni su razvili niz alata za praćenje remijelinacije, kako na životinjskim modelima MS tako i kod pacijenata sa MS, pokazujući da prednosti koje se vide od klemastina dolaze od remijelinacije – i ukazujući na način na koji treba testirati i procenjivati nove lekove.
Takođe su otkrili da prednosti klemastina potiču od blokiranja samo jednog od pet muskarinskih receptora, M1R, ali je efekat na M1R bio srednji, a lek je uticao i na druge receptore. Idealan lek bi morao da se fokusira na M1R.
U ovom trenutku, naučnicima UCSF-a je bio potreban industrijski partner za unapređenje projekta. Konačno, Contineum Therapeutics (tada poznata kao Pipeline Therapeutics) je formirana kako bi zauzela pedantan pristup stvaranju tog idealnog leka. Čen i Grin su pomogli kompaniji da potvrdi da je M1R prava meta za lek za remijelinizaciju, a zatim da napravi lek koji ga isključivo blokira.
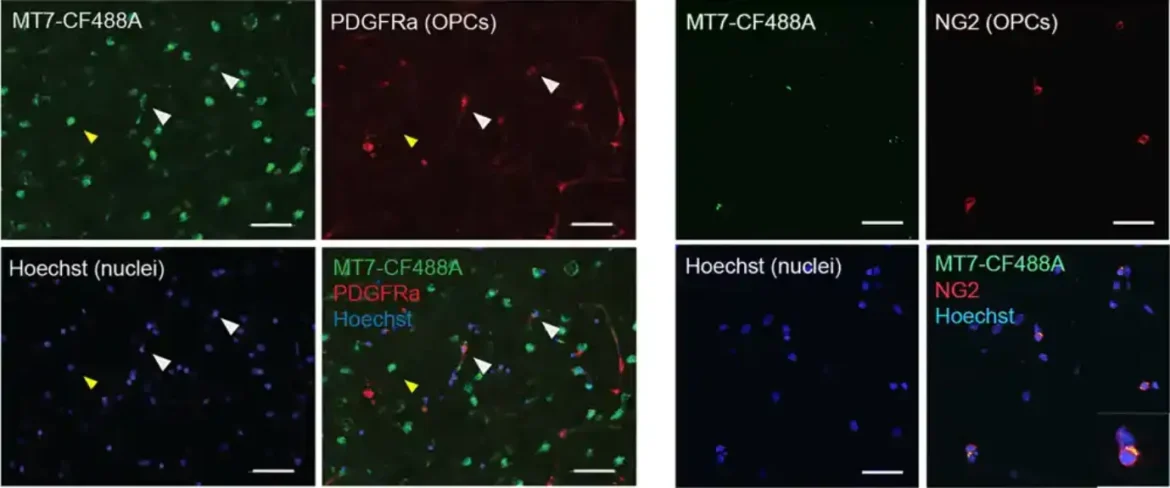
Pun, biolog iz Contineuma, shvatio je da MT7, toksin pronađen u otrovu smrtonosne zelene zmije mambe, može otkriti tačno gde se M1R nalazi u mozgu.
„Morali smo da dokažemo, van svake sumnje, da je M1R bio prisutan u OPC-ima koji su bili blizu štete koju je prouzrokovao MS“, rekao je Pun. „MT7, koji je izuzetno selektivan za M1R, odgovara ovome.“
Pun je koristio MT7 da napravi molekularnu oznaku za M1R koja je otkrila prstenove OPC-a koji se okupljaju oko oštećenja u mišjem modelu MS i u ljudskom MS tkivu.
Tim medicinskih hemičara u Contineumu, predvođen dr Austinom Čenom, zatim je počeo da radi na leku koji su Chan i Green zamislili, dizajnirajući PIPE-307 da snažno blokira M1R i uđe u mozak.
Istraživači su testirali efekte novog leka na OPC uzgajane u petrijevim posudama i životinjske modele MS koristeći Chan-ove i Greenove metode za praćenje remijelinacije. PIPE-307 je blokirao M1R receptor mnogo bolje od klemastina; podstakao je OPC da sazre u oligodendrocite i počnu mijelinizirati obližnje aksone; i prešao je krvno-moždanu barijeru.
Ali što je najvažnije, preokrenuo je degradaciju viđenu u mišjem modelu MS.
„Možda se čini da lek deluje u ovim apstraktnim scenarijima, utičući na pravi receptor ili ćeliju, ali ključni nalaz je bio stvarni oporavak funkcije nervnog sistema“, rekao je Čen.
Godine 2021, PIPE-307 je prošao kliničko ispitivanje prve faze, demonstrirajući njegovu bezbednost. Trenutno se testira kod pacijenata sa MS u fazi II.
Ako uspe, moglo bi da promeni način na koji se leči MS.
„Svaki pacijent kod kojeg dijagnostikujemo MS dolazi sa nekim stepenom već postojećih povreda“, rekao je Grin. „Sada bismo mogli imati priliku ne samo da zaustavimo njihovu bolest, već i da izlečimo.“