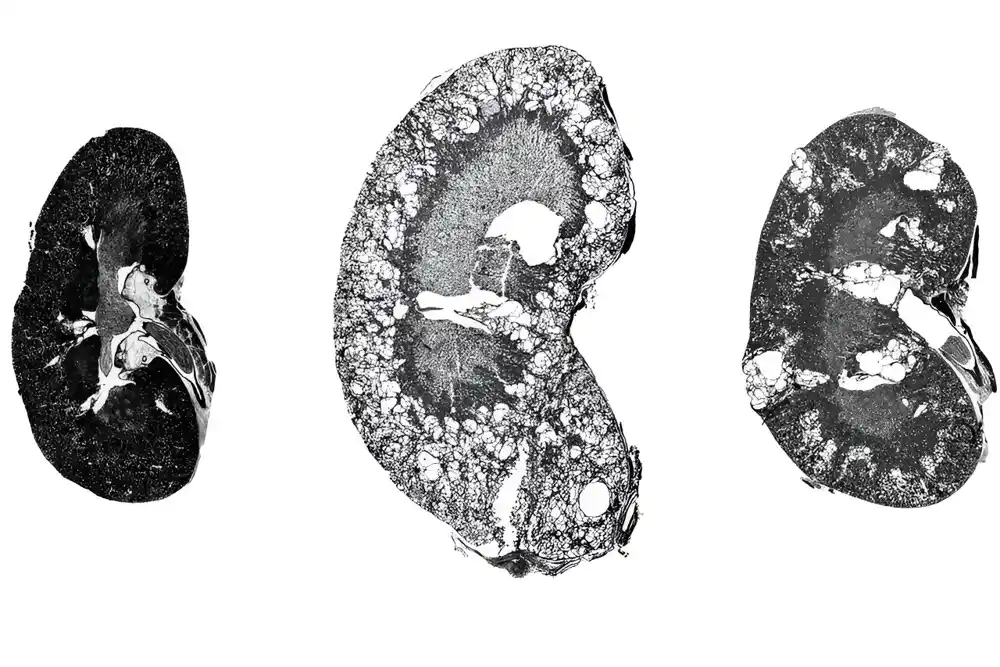
Autozomno dominantna bolest policističnih bubrega (ADPKD), najčešći oblik policistične bolesti bubrega, može dovesti do uvećanja bubrega i eventualnog gubitka funkcije. Bolest pogađa više od 12 miliona ljudi širom sveta, a mnogim pacijentima je potrebna dijaliza ili transplantacija bubrega do 60. godine.
Istraživači sa MIT-a i Medicinskog fakulteta Univerziteta Jejl sada su otkrili da jedinjenje koje je prvobitno razvijeno kao potencijalni lek za rak obećava lečenje ADPKD. Lek deluje tako što iskorišćava ranjivost ćelija ciste bubrega na oksidativni stres – stanje neravnoteže između štetnih slobodnih radikala i korisnih antioksidanata.
U studiji koja je koristila dva mišja modela bolesti, istraživači su otkrili da je lek dramatično smanjio ciste bubrega bez oštećenja zdravih ćelija bubrega.
„Stvarno verujemo da ovo ima potencijal da utiče na ovu oblast i obezbedi drugačiju paradigmu lečenja ove važne bolesti“, kaže Bogdan Fedeles, naučnik i menadžer programa u MIT-ovom Centru za zdravstvene nauke o životnoj sredini i glavni autor studije, koja je predstavljen ove nedelje u Zborniku radova Nacionalne akademije nauka .
John Essigmann, Villiam R. i Betsi P. Leitch profesor biološkog inženjerstva i hemije na MIT-u; Sorin Fedeles, izvršni direktor Konzorcijuma za ishode bolesti policističnih bubrega i docent (dodatni) na Medicinskom fakultetu Univerziteta Jejl; i Stefan Somlo, C.N.H. Dugogodišnji profesor medicine i genetike i šef nefrologije na Medicinskom fakultetu Univerziteta Jejl, stariji su autori rada.
ADPKD obično napreduje sporo. Često se dijagnostikuje kada su pacijenti u 30-im godinama, obično ne izaziva ozbiljno oštećenje funkcije bubrega sve dok pacijenti ne dostignu 60-te. Jedini lek koji je FDA odobrila za lečenje bolesti, tolvaptan, usporava rast cista, ali ima neželjene efekte koji uključuju često mokrenje i moguće oštećenje jetre.
Esigmanova laboratorija nije prvobitno imala namjeru da proučava PKD; nova studija je nastala kao rezultat rada na potencijalnim novim lekovima za rak. Pre skoro 25 godina, naučnik MIT-a Robert Kroj, takođe autor nove PNAS studije, dizajnirao je jedinjenja koja sadrže agens koji oštećuje DNK poznat kao anilinski senf, koji može da izazove smrt ćelija u ćelijama raka.
Sredinom 2000-ih, Fedeles, tada postdiplomski student u Esigmanovoj laboratoriji, zajedno sa Esigmanom i Krojem, otkrio je da, osim što oštećuju DNK, ova jedinjenja takođe izazivaju oksidativni stres ometajući mitohondrije – organele koje stvaraju energiju za ćelije.
Tumorske ćelije su već pod oksidativnim stresom zbog svog abnormalnog metabolizma. Kada se tretiraju ovim jedinjenjima, poznatim kao 11beta jedinjenja, dodatni poremećaj pomaže u ubijanju ćelija. U studiji objavljenoj 2011. godine, Fedeles je izvestio da tretman sa 11beta jedinjenjima značajno potiskuje rast tumora prostate implantiranih kod miševa.
Razgovor sa njegovim bratom, Sorinom Fedelesom, koji proučava policističnu bolest bubrega, naveo je par da teoretizira da bi ova jedinjenja takođe mogla biti dobri kandidati za lečenje bubrežnih cista. U to vreme, istraživanja u ADPKD su počela da sugerišu da ćelije ciste bubrega takođe doživljavaju oksidativni stres, zbog abnormalnog metabolizma koji podseća na metabolizam ćelija raka.
„Razgovarali smo o mehanizmu šta bi bio dobar lek za policističnu bolest bubrega, i imali smo tu intuiciju da bi jedinjenja sa kojima sam radio zapravo mogla da utiču na ADPKD“, kaže Bogdan Fedeles.
11beta jedinjenja deluju tako što ometaju sposobnost mitohondrija da generišu ATP (molekule koje ćelije koriste za skladištenje energije), kao i kofaktor poznat kao NADPH, koji može delovati kao antioksidans i pomaže ćelijama da neutrališu štetne slobodne radikale. Tumorske ćelije i ćelije ciste bubrega imaju tendenciju da proizvode povećane nivoe slobodnih radikala zbog oksidativnog stresa pod kojim su. Kada se ove ćelije tretiraju 11beta jedinjenjima, dodatni oksidativni stres, uključujući dalje smanjenje NADPH, gura ćelije preko ivice.
„Malo oksidativnog stresa je u redu, ali cistične ćelije imaju nizak prag da ga tolerišu. Dok normalne ćelije preživljavaju tretman, cistične ćelije će umreti jer prelaze taj prag“, kaže Esigman.
Koristeći dva različita mišja modela ADPKD, istraživači su pokazali da 11beta-dihloro može značajno smanjiti veličinu bubrežnih cista i poboljšati funkciju bubrega.
Istraživači su takođe sintetizovali „defanzivnu“ verziju jedinjenja zvanog 11beta-dipropil, koja ne uključuje nikakvu sposobnost direktnog oštećenja DNK i potencijalno bi mogla biti bezbednija za upotrebu kod ljudi. Oni su testirali ovo jedinjenje u modelu ranog početka PKD i otkrili da je efikasno kao 11beta-dihloro.
U svim eksperimentima, zdrave ćelije bubrega nisu bile pogođene tretmanom. To je zato što su zdrave ćelije u stanju da izdrže mali porast oksidativnog stresa, za razliku od obolelih ćelija, koje su veoma podložne svim novim poremećajima, kažu istraživači. Pored obnavljanja funkcije bubrega, tretman je takođe poboljšao druge kliničke karakteristike ADPKD; biomarkeri za upalu tkiva i fibrozu su smanjeni kod tretiranih miševa u poređenju sa kontrolnim životinjama.
Rezultati takođe sugerišu da kod pacijenata, tretman sa 11beta jedinjenjima jednom u nekoliko meseci, ili čak jednom godišnje, može značajno da odloži napredovanje bolesti i na taj način izbegne potrebu za kontinuiranim, opterećujućim antiproliferativnim terapijama kao što je tolvaptan.
„Na osnovu onoga što znamo o paradigmi rasta ciste, teoretski možete lečiti pacijente na pulsirajući način – jednom godišnje, ili možda čak i ređe – i imati značajan uticaj na ukupan volumen bubrega i funkciju bubrega“, kaže Sorin Fedeles .
Istraživači se sada nadaju da će sprovesti dalje testove na 11beta-dipropil, kao i da će razviti načine za njegovu proizvodnju u većem obimu. Takođe planiraju da istraže srodna jedinjenja koja bi mogla biti dobri kandidati za lekove za PKD.