Dolazak Pakslovida u decembru 2021. označio je još jednu prekretnicu u pandemiji COVID-19 – efikasnog antivirusnog leka koji je od tada uspešno lečio milione. Ali kao i mnogi antivirusni lekovi pre toga, naučnici znaju da će u nekom trenutku Paklsovid verovatno izgubiti izvesnu efikasnost zbog rezistencije na lekove. Istraživači koji rade na tome da budu ispred takvih pretnji u nastajanju sada su identifikovali potpuno novi način lečenja SARS-CoV-2 infekcija – posao koji može imati još šire implikacije.
U stvari, nova studija laboratorije Tuschl uvodi dokaz o konceptu za novu klasu antivirusnih lekova koji bi ciljali tip enzima koji je neophodan ne samo za SARS, već i mnoge RNK viruse, uključujući ebolu i dengu, kao i virusi DNK koji se repliciraju u citosolu, uključujući viruse boginja. Nalazi mogu otvoriti put za brži i snažniji odgovor na buduće pandemije.
„Niko ranije nije pronašao način da inhibira ovaj enzim“, kaže Thomas Tuschl, profesor F. M. Al Akl i Margaret Al Akl na Rockefelleru. „Naš rad uspostavlja kap metil transferazu enzime kao terapijske mete i otvara vrata za mnogo više antivirusnih razvoja protiv patogena protiv kojih smo do sada imali samo ograničena sredstva za borbu.“
Istraživanje je objavljeno u časopisu Nature.
Način na koji toliki RNK virusi napreduju je modifikovanje njihovih RNK kapica, specijalizovanih struktura koje stabilizuju virusnu RNK, poboljšavaju njenu translaciju i oponašaju mRNK domaćina kako bi izbegli imunološku odbranu. Ograničavanje RNK se oslanja na enzime zvane metiltransferaze – što ga čini primamljivom metom za antivirusne terapije.
Ali većina antivirusnih lekova, uključujući Pakslovid, umesto toga se fokusira na ometanje proteaza, različite klase virusnih enzima koji razgrađuju proteine – uglavnom zato što su ti enzimi prethodno bili ciljani i sprečili širenje virusa.
„Inhibicija metiltransferaze potrebna je korišćenjem nekonvencionalnog RNK supstrata, dodajući novi izazov otkrivanju lekova“, kaže Tuschl.
Za Tušla, stručnjaka za RNK čiji je rad već doveo do višestrukih RNK terapija za lečenje genetskih poremećaja, to nije bila velika komplikacija. I nakon što je restrukturirao svoju laboratoriju tokom pandemije kako bi se fokusirao na otkrivanje antivirusnih lekova, Tuschl je shvatio da postoje jasne prednosti gledanja dalje od inhibitora proteaze.
Tuschl je sumnjao da je manje verovatno da će virusi izbegavati kombinovanu terapiju koja je istovremeno ciljala dva nepovezana virusna enzima, kao što je inhibitor proteaze pored inhibitora metiltransferaze. Takođe je shvatio da će lekovi koji ciljaju virusnu metiltransferazu različitu strukturom od ljudskog enzima biti visoko selektivni i neće narušiti funkciju ljudskog enzima.
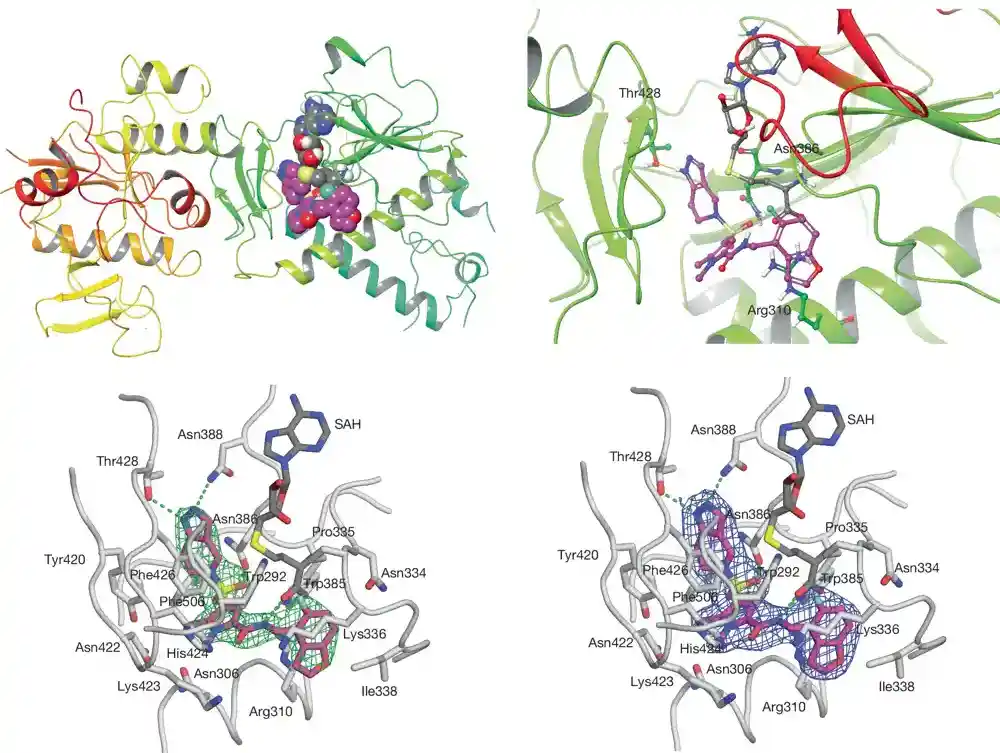
U potrazi za molekulom sposobnim da inhibira SARS-CoV-2 metiltransferazu NSP14, njegov tim je pregledao 430.000 jedinjenja na početku pandemije u Univerzitetskom Resursnom centru Fisher Drug Discoveri Resource Center i otkrio mali broj jedinjenja koja inhibiraju virusnu kapicu metiltransfera NSP114. multifunkcionalni enzim sa aktivnost metiltransferaze.
Ta jedinjenja su zatim prošla kroz opsežan proces hemijskog razvoja kako bi se stvorili optimizovani kandidati za lekove u partnerstvu sa Sanders Tri-Institutional Therapeutics Discoveri Institute. Jedinjenja sa poboljšanom biohemijskom inhibicijom su zatim podvrgnuta testovima zasnovanim na ćelijama koje su sproveli istraživači predvođeni Čarlsom M. Rajsom, koji je na čelu Laboratorije za virusologiju i infektivne bolesti u Rokfeleru.
Konačno, kolege u Centru za otkriće i inovacije u Nju Džersiju su zatim testirale jedinjenje na miševima pod bezbednosnim uslovima BL3 i demonstrirali da može da leči COVID-19 uporedo sa Pakslovidom. Tuschl i kolege su takođe pokazali da je tretman ostao efikasan čak i ako je virus mutirao kao odgovor na njega, i da je postojala sinergija kada se kombinuje sa inhibitorima proteaze.
„Čak i u izolaciji, virus bi imao problema da pobegne iz ovog jedinjenja“, kaže Tušl. „Ali kao kombinovana terapija zajedno sa inhibitorom proteaze – bekstvo bi bilo gotovo nemoguće.“
Nalazi ne samo da potvrđuju virusne metiltransferaze kao obećavajuću terapijsku metu, već takođe sugerišu da bi Tuschlov specifični inhibitor imao minimalne neželjene efekte.
„Mehanizam kojim lek deluje je jedinstven“, primećuje on.
U stvari, jedinjenje koristi prednosti jedinstvenih strukturnih karakteristika virusne metiltransferaze koje takođe zahtevaju prisustvo reakcionog proizvoda SAM donora metila, što znači da jedinjenje laboratorije selektivno cilja na virus bez ometanja ljudskih procesa.
„Nismo spremni da testiramo jedinjenje na ljudima“, upozorava Tušl. Idealnom kliničkom kandidatu je potrebna poboljšana stabilnost, bioraspoloživost i niz drugih farmakoloških svojstava koja ostaju da se optimizuju na duži rok. „Mi smo akademska laboratorija. Za to bi nam trebao industrijski partner.“
U bliskoj budućnosti, Tuschl laboratorija proširuje ovaj rad kako bi istražila inhibitore za RSV, flaviviruse, kao što su denga i zika, kao i mpok, pa čak i gljivične infekcije, koje svi dele sličnu enzimsku ranjivost.
„Ovaj rad otvara vrata za ciljanje mnogih patogena“, kaže on. „To je nova prilika da se pripremimo za buduće pandemije.“