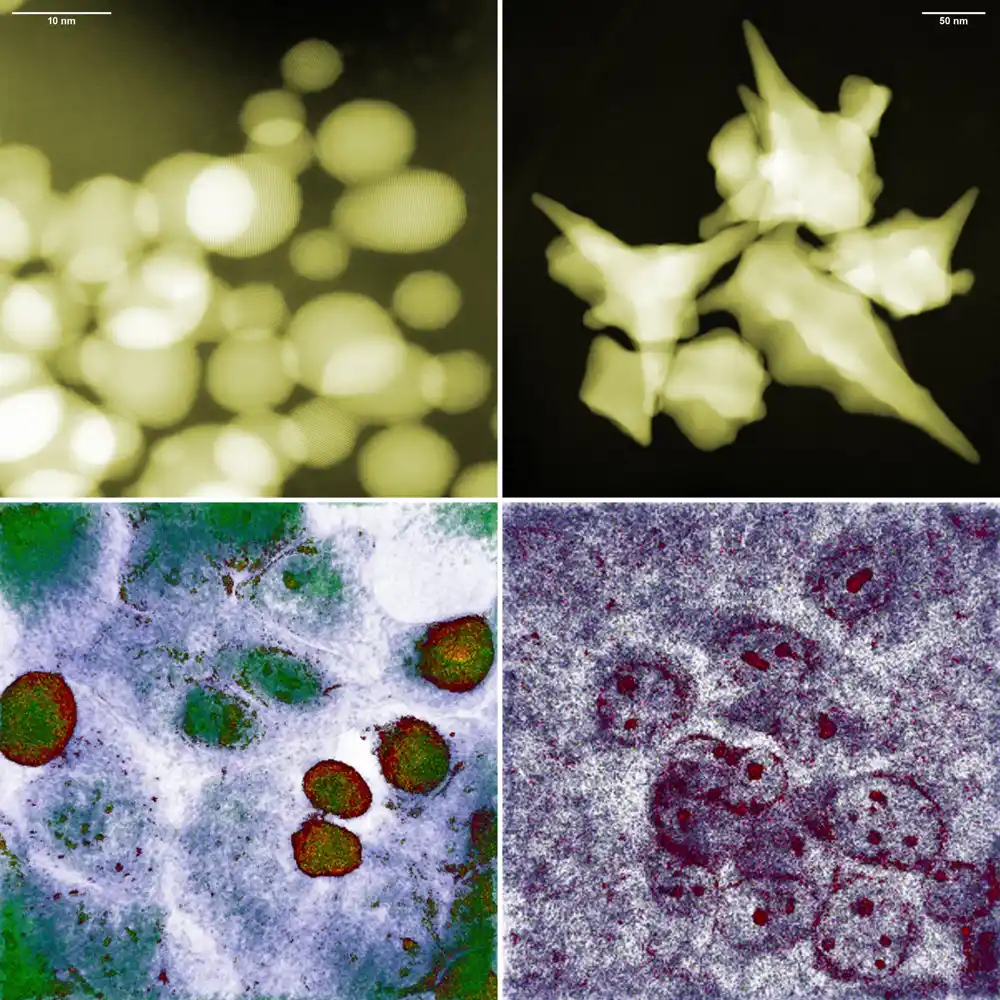
Čestice zlata veličine milijarditih delova metra smrtonosne su za ćelije raka. Ova činjenica je poznata dugo vremena, kao i jednostavna korelacija: što su manje nanočestice koje se koriste za borbu protiv ćelija raka, one brže umiru. Međutim, zanimljivija, složenija slika ovih interakcija proizilazi iz najnovijeg istraživanja, sprovedenog na Institutu za nuklearnu fiziku Poljske akademije nauka, koristeći novu mikroskopsku tehniku.
Manji ubijaju brže – ovo je ono što se ranije mislilo o zlatnim nanočesticama koje se koriste za borbu protiv ćelija raka. Naučnici su mislili da će male nanočestice jednostavno lakše prodreti u unutrašnjost ćelije raka, gde bi njihovo prisustvo dovelo do metaboličkih poremećaja i na kraju do smrti ćelije.
Ispostavilo se da je stvarnost složenija, što je pokazalo istraživanje koje su sproveli naučnici sa Instituta za nuklearnu fiziku Poljske akademije nauka (IFJ PAN) u Krakovu, uz podršku teorijske analize sprovedene na Univerzitetu u Žešovu ( UR) i Tehnološki univerzitet u Žešovu.
„Naš institut ima najsavremeniji medicinski i akceleratorski centar za protonsku radioterapiju. Dakle, kada su se pre nekoliko godina pojavili izveštaji da bi nanočestice zlata mogle da budu dobri radiosenzibilizatori i da poboljšaju efikasnost ove vrste terapije, počeli smo da ih sintetišemo. i testiramo njihovu interakciju sa ćelijama raka. Brzo smo otkrili da toksičnost nanočestica nije uvek bila onakva kakva se očekivala“, kaže dr Joanna Depciuch-Czarni (IFJ PAN), inicijator istraživanja i prvi autor članka u kojem se raspravlja o rezultatima. , objavljen u časopisu Small .
Nanočestice se mogu proizvesti korišćenjem različitih metoda, čime se dobijaju čestice različitih veličina i oblika. Ubrzo nakon što su započeli sopstvene eksperimente sa nanočesticama zlata, fizičari IFJ PAN-a su primetili da biologija ne sledi popularno pravilo da je njihova toksičnost veća što su one manje.
Pokazalo se da su sferne nanočestice veličine 10 nanometara, proizvedene u Krakovu, praktično bezopasne za proučavanu ćelijsku liniju glioma. Međutim, primećen je visok mortalitet u ćelijama izloženim nanočesticama veličine čak 200 nanometara, ali sa strukturom u obliku zvezde.
Razjašnjenje navedene kontradikcije postalo je moguće zahvaljujući upotrebi prvog holotomografskog mikroskopa u Poljskoj, na IFJ PAN-u.
Tipičan CT skener skenira ljudsko telo pomoću rendgenskih zraka i rekonstruiše njegovu prostornu unutrašnju strukturu deo po deo. U biologiji, sličnu funkciju nedavno je obavljao holotomografski mikroskop. Ovde su ćelije takođe zahvaćene snopom zračenja, ali ne visokoenergetskog, već elektromagnetnog zračenja. Njegova energija je odabrana tako da fotoni ne remete ćelijski metabolizam.
Rezultat skeniranja je skup holografskih poprečnih preseka koji sadrže informacije o raspodeli promena indeksa prelamanja. Pošto se svetlost različito prelama na citoplazmi i različito na ćelijskoj membrani ili jezgru, moguće je rekonstruisati trodimenzionalnu sliku i same ćelije i njene unutrašnjosti.
„Za razliku od drugih tehnika mikroskopije visoke rezolucije, holotomografija ne zahteva pripremu uzoraka ili unošenje bilo kakvih stranih supstanci u ćelije. Interakcije zlatnih nanočestica sa ćelijama raka mogle bi se stoga posmatrati direktno u inkubatoru, gde su potonje uzgajane. , u neometanom okruženju – štaviše, sa nanometrijskom rezolucijom – sa svih strana istovremeno i praktično u realnom vremenu“, nabraja dr Depčiuh-Čarni.
Jedinstvene karakteristike holotomografije omogućile su fizičarima da utvrde uzroke neočekivanog ponašanja ćelija raka u prisustvu zlatnih nanočestica. Serija eksperimenata je sprovedena na tri ćelijske linije: dva glioma i jedna debelo crevo. Između ostalog, primećeno je da iako su male, sferične nanočestice lako prodrle u ćelije raka, ćelije su se regenerisale i čak ponovo počele da se dele, uprkos početnom stresu.
U slučaju ćelija raka debelog creva, nanočestice zlata su brzo potisnute iz njih. Situacija je bila drugačija za velike nanočestice u obliku zvezde. Njihovi oštri vrhovi su perforirali ćelijske membrane, što je najverovatnije rezultiralo povećanjem oksidativnog stresa unutar ćelija. Kada ove ćelije više nisu mogle da se nose sa popravkom sve veće štete, pokrenuo se mehanizam apoptoze, ili programirane smrti.
„Koristili smo podatke iz eksperimenata u Krakovu da bismo izgradili teorijski model procesa depozicije nanočestica unutar ćelija koje se proučavaju. Konačni rezultat je diferencijalna jednačina u koju se mogu zameniti odgovarajuće obrađeni parametri — za sada samo opisuje oblik. i veličinu nanočestica—kako bi se brzo utvrdilo kako će se uzimanje analiziranih čestica u ćelijama raka odvijati u datom vremenskom periodu“, kaže dr Pavel Jakubčik, profesor na UR i koautor modela.
On naglašava: „Svaki naučnik već može da koristi naš model u fazi projektovanja sopstvenog istraživanja kako bi trenutno suzio broj varijanti nanočestica koje zahtevaju eksperimentalnu verifikaciju.
Mogućnost da se lako smanji broj potencijalnih eksperimenata koji će se sprovesti znači smanjenje troškova povezanih sa kupovinom ćelijskih linija i reagenasa, kao i značajno smanjenje vremena istraživanja (obično je potrebno oko dve nedelje samo za kultivisanje a. komercijalno dostupna ćelijska linija). Pored toga, model se može koristiti za dizajniranje bolje ciljanih terapija nego ranije – onih u kojima će nanočestice biti posebno dobro apsorbovane od strane odabranih ćelija raka, uz održavanje relativno niske ili čak nulte toksičnosti za zdrave ćelije u drugim organima pacijenta.
Grupa naučnika Krakov-Žešov već se sprema da nastavi svoja istraživanja. Novi eksperimenti bi uskoro trebalo da omoguće proširenje modela interakcije nanočestica sa ćelijama raka kako bi uključili dalje parametre, kao što su hemijski sastav čestica ili drugi tipovi tumora. Kasniji planovi takođe uključuju dopunu modela matematičkim elementima kako bi se optimizovala efikasnost foto- ili protonske terapije za naznačene kombinacije nanočestica i tumora.