Međunarodni tim istraživača identifikovao je ključni genetski mehanizam koji reguliše formiranje i migraciju ćelija kranijalnog nervnog grebena, koje su neophodne za razvoj struktura lica.
Ovo otkriće, objavljeno u The American Journal of Human Genetics, proširuje naše razumevanje uloge specifičnih gena u kritičnom koraku embrionalnog razvoja i utire put za dublji uvid u genetske uzroke određenih urođenih bolesti.
Ova studija je otkrila kako gen ZIC2, u saradnji sa kompleksom ARID1A-BAF, igra ključnu ulogu u procesu poznatom kao epitelno-mezenhimalni prelaz (EMT). Ovaj proces omogućava ćelijama da promene oblik i migriraju na svoja odredišta unutar embriona kako bi formirali organe i tkiva, uključujući strukture lica.
Studiju je zajedno vodila Eloisa Herera, šef laboratorije za generisanje i regeneraciju bilateralnih neuronskih kola na Institutu za neuronauke (IN), zajedničkom centru Španskog nacionalnog istraživačkog saveta (CSIC) i Univerziteta Migel Hernandez (UMH) iz Elčea i Marko Tricino, čija je laboratorija na Imperijal koledžu u Londonu specijalizovana za proučavanje ljudskih matičnih ćelija.
Tim je sproveo eksperimente koristeći matične ćelije dobijene od pacijenata sa Coffin-Sirisovim sindromom (CSS), retkim genetskim poremećajem uzrokovanim nedovoljnom funkcijom gena. CSS karakterišu abnormalnosti u različitim delovima tela, uključujući defekte udova, intelektualnu nesposobnost i kraniofacijalne malformacije.
Ove ćelije su korišćene za proučavanje kako genetske promene u ARID1A utiču na genetske programe EMT-a i funkciju ZIC2 gena. Analize su koristile napredne tehnike kao što su RNA-sek i ChIP-sek, koje su omogućile identifikaciju gena regulisanih ovom molekularnom osovinom.
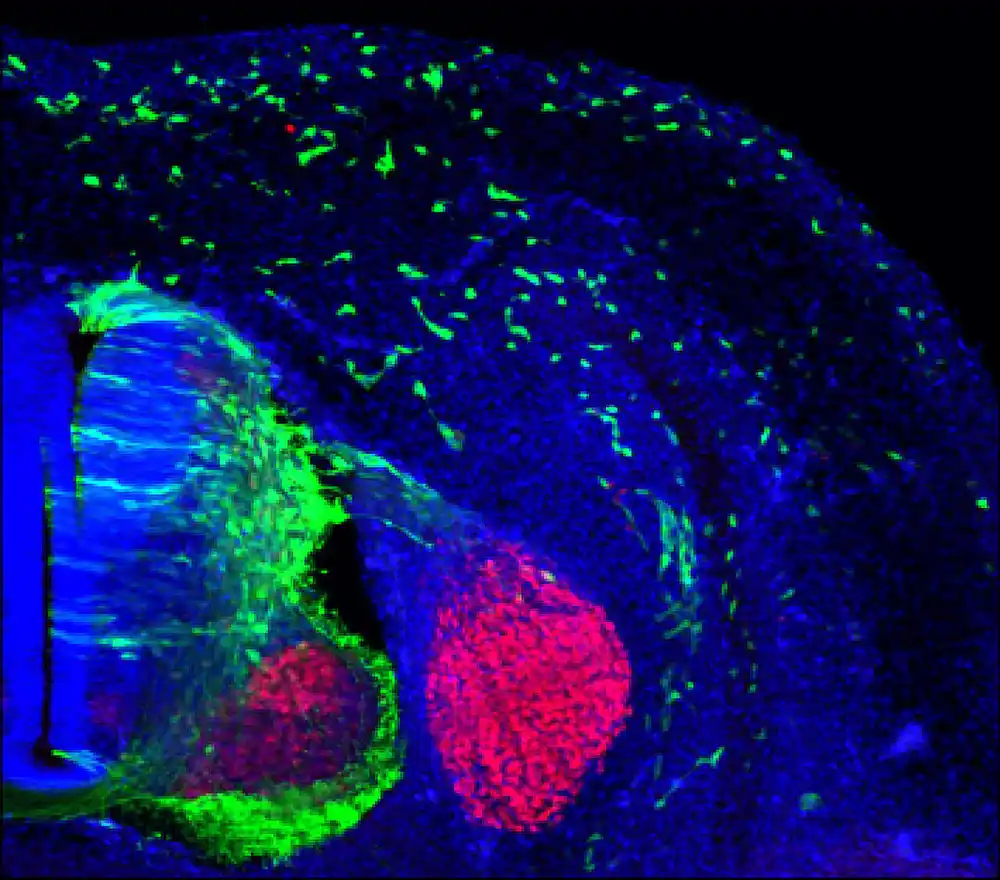
Pored toga, tim je koristio životinjske modele, uključujući miševe i pileće embrione, da posmatra in vivo kako ZIC2 reguliše migraciju ćelija nervnog grebena i da ispita defekte povezane sa gubitkom ARID1A tokom kraniofacijalnog razvoja. „Ovako smo otkrili da se ZIC2 eksprimuje u premigratornim ćelijama nervnog grebena, neposredno pre nego što počnu migraciju“, primećuje Herrera.
Nalazi ove studije otkrivaju da ARID1A reguliše suštinski genetski program za EMT, pri čemu je ZIC2 identifikovan kao jedan od najkritičnijih gena u ovom procesu. Ako ARID1A ne funkcioniše ispravno, ZIC2 ne može da zauzme genomska mesta potrebna za aktiviranje gena povezanih sa EMT, ometajući migraciju nervnog grebena, pokrećući aberantne ćelijske putanje i dovodeći do kraniofacijalnih defekata.
Ovo istraživanje baca svetlo na genetske mehanizme koji su u osnovi kraniofacijalnog razvoja i pruža vredne uvide za razvoj ciljanih terapija. „Razumevanje načina na koji ZIC2 i ARID1A interaguju tokom razvoja daje nam ključni alat za istraživanje potencijalnih tretmana za urođene genetske bolesti“, zaključuje Herrera.