Neurodegenerativne bolesti, kao što su Alchajmerova i Parkinsonova bolest, predstavljaju značajan zdravstveni izazov, koji pogađa preko 50 miliona ljudi širom sveta. Jedna zajednička karakteristika ovih bolesti je akumulacija pogrešno savijenih proteinskih agregata u mozgu, poznatih kao amiloidni fibrili, koji ometaju normalnu funkciju ćelije i na kraju dovode do ćelijske smrti.
U novoj studiji, naučnici predvođeni Hilalom Lašuelom iz EPFL-a i Metjuom R. Pratom sa USC-a, napravili su značajan napredak u razumevanju kako post-translacione modifikacije (PTM) — promene koje se dešavaju proteinima nakon što se sintetišu u ćeliji — mogu uticati formiranje i patogenost ovih amiloidnih fibrila .
Istraživači su proučavali protein alfa-sinuklein, koji je povezan sa formiranjem amiloidnih fibrila kod Parkinsonove bolesti. Istraživači su posmatrali specifičnu modifikaciju koju protein prolazi, tehnički poznatu kao „O-vezani β-N-acetilglukozamin“ ili skraćeno O-GlcNAc.
O-GlcNAc je vrsta modifikacije koja dodaje jedan molekul šećera specifičnim ostacima serina ili treonina u proteinu, čime se menja njegova funkcija i svojstva. Povezan je sa nekoliko bioloških procesa, uključujući agregaciju proteina i neurodegeneraciju. Pokazalo se da ova modifikacija, posebno na alfa-sinukleinu, usporava agregaciju amiloida i potencijalno štiti neurone.
Prethodne studije Prat-ove i Lashuelove grupe sugerišu da povećanje modifikacije O-GlcNAc može imati terapeutski potencijal u ranim stadijumima neurodegenerativne bolesti, menjajući svojstva proteinskih agregata kako bi se sprečilo njihovo zasijavanje i širenje u mozgu, potencijalno usporavajući napredovanje bolesti.
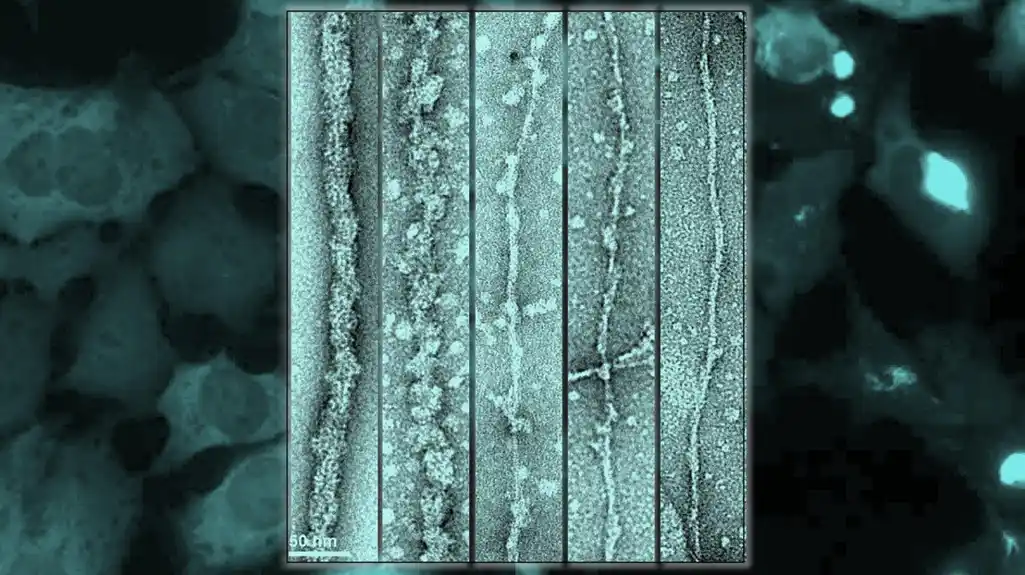
Nadovezujući se na ovo, tim je koristio inovativne hemijske metode za proizvodnju modifikovanih alfa-sinukleinskih fibrila, radeći sa grupom Virdžinije Li na Univerzitetu u Pensilvaniji. Takođe su koristili ćelijske i životinjske modele da prouče kako O-GlcNAc utiče na patogena svojstva alfa-sinukleina, i radili su sa grupom Lorene Saelices u UT Southvestern Medical Center kako bi posmatrali modifikovane fibrile pomoću krio-elektronske mikroskopije.
Studija je pokazala da povećana modifikacija proizvodi fibrile sa različitim strukturnim i biohemijskim karakteristikama. Ove fibrile rezultiraju sojem amiloidnih fibrila sa dramatično smanjenom sposobnošću agregacije semena u neuronima i životinjskim modelima Parkinsonove bolesti. Zanimljivo je da ovaj soj fibrila može da stvori agregaciju in vitro, ali ne u neuronima ili živim miševima.
„Naši nalazi pokazuju da ovo okruženje u ćeliji igra važnu ulogu u određivanju patogenosti ovog proteina“, kaže Anne-Laure Mahul, jedan od prvih autora studije.
Studija sugeriše da modifikacije poput O-GlcNAc mogu igrati ulogu u modulaciji patogenosti alfa-sinukleina, što otvara nove puteve za istraživanje i potencijalne tretmane. Na primer, ciljanje na proces modifikacije O-GlcNAc može dovesti do terapija koje menjaju napredovanje Parkinsonove bolesti utičući na sposobnost patogenih vrsta alfa-sinukleina da se šire u različite regione mozga.
U povezanom Research Briefing bi Nature, autori pišu: „[Naš rad na O-GlcNac modifikaciji [alfa-sinukleina] baca novo svetlo na molekularne determinante patobiologije amiloidnih fibrila i pruža nove terapeutske ciljeve za prevenciju rast i širenje amiloida u ranim i kasnim fazama razvoja i progresije bolesti.“