Efikasna borba protiv raka često uključuje zaustavljanje umnožavanja ćelija raka, što zahteva razumevanje proteina na koje se ćelije oslanjaju da bi preživele. Profilisanje proteina igra ključnu ulogu u ovom procesu pomažući istraživačima da identifikuju proteine – i njihove specifične delove – na koje bi budući lekovi trebalo da budu usmereni. Ali kada se koriste sami, prošli pristupi nisu bili dovoljno detaljni da ukažu na sve potencijalne ciljeve proteina, što je dovelo do toga da su neki promašeni.
Sada, kombinovanjem dve metode analize proteina, tim hemičara u Scripps Research-u mapirao je više od 300 malih molekul reaktivnih proteina karcinoma, kao i njihova mesta vezivanja za male molekule. Otkrivanje ključnih proteinskih ciljeva koji – kada se poremete određenim hemijskim jedinjenjima (ili malim molekulima) – zaustavljaju rast ćelija raka može na kraju omogućiti razvoj efikasnijih i preciznijih tretmana raka. Nalazi se pojavljuju u Nature Chemistry.
„Jedan metod nam je dao širok uvid u to koji proteini su u interakciji sa hemikalijama, a drugi metod je pokazao gde se tačno te interakcije dešavaju“, kaže ko-stariji autor Benjamin Cravatt, dr., katedra Norton B. Gilula u Biologija i hemija u Scripps Research-u.
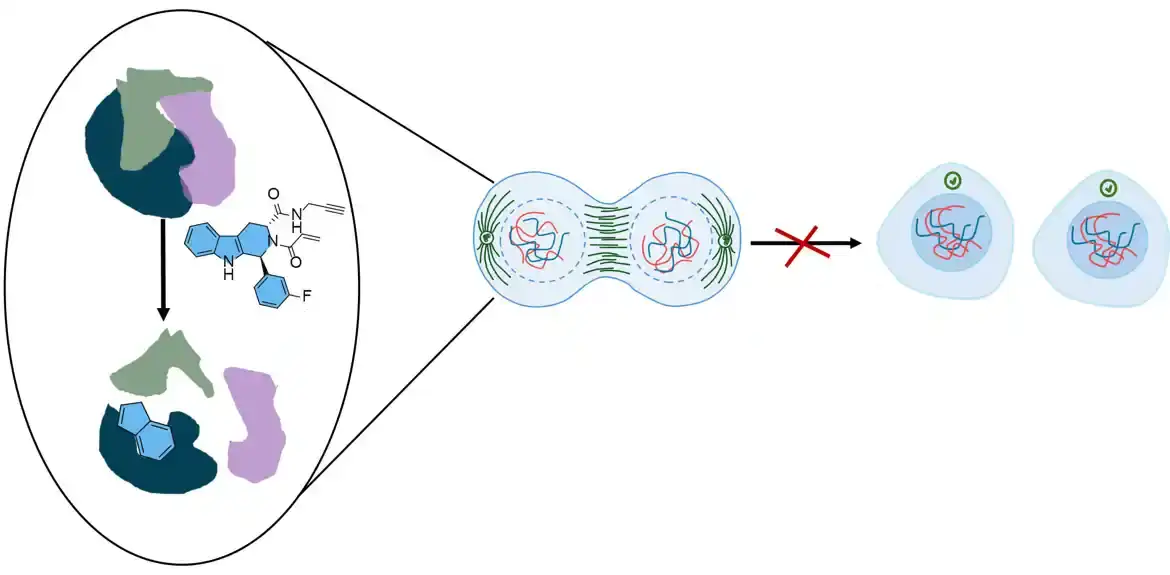
Obe metode su oblici profilisanja proteina zasnovanih na aktivnosti (ABPP), tehnika koju je Kravat uveo u hvatanje proteinske aktivnosti na globalnom nivou. Istraživački tim je koristio svoj dvostruki pristup da označi i proteine i proteinska mesta koja su stupila u interakciju sa bibliotekom stereosonda – hemijskih jedinjenja dizajniranih da se trajno vezuju za proteine na selektivan način. Stereosonde se koriste za proučavanje funkcija proteina i identifikaciju mogućih meta lekova.
„Uložili smo svesni napor da dizajniramo naše stereosonde sa hemijskim karakteristikama koje su obično nedovoljno zastupljene u jedinjenjima koja se obično koriste u okruženju za otkrivanje lekova“, kaže ko-stariji autor dr Bruno Melilo, istraživač instituta na Odeljenju za hemiju na Scripps Research. „Ova strategija povećava naše šanse za otkrića koja mogu unaprediti biologiju i na kraju dovesti do poboljšanja ljudskog zdravlja.
Stereosonde istraživačkog tima bile su elektrofilne, što znači da su dizajnirane da se nepovratno vezuju za proteine – posebno za cistein. Ova aminokiselina je prisutna u proteinima, uključujući one koji se nalaze u ćelijama raka, i pomaže u formiranju važnih strukturnih veza. Kada hemikalije reaguju sa cisteinom, one mogu poremetiti ove veze i uzrokovati kvar proteina, što ometa rast ćelija, a mnogi lekovi protiv raka se nepovratno vezuju za cisteine na proteinima.
„Takođe smo se fokusirali na cistein jer je to najnukleofilnija aminokiselina“, kaže prvi autor dr Evert Njomen, saradnik HHMI Hanna H. Grei u Scripps Research-u i postdoktorski naučni saradnik u Cravatt-ovoj laboratoriji.
Da bi saznali koji specifični proteini bi se povezali sa stereosondama, tim se okrenuo metodi poznatoj kao ABPP usmeren na proteine. Koristeći ovaj pristup, istraživači su otkrili više od 300 pojedinačnih proteina koji su reagovali sa jedinjenjima stereosonde. Ali ipak su želeli da kopaju dublje i identifikuju precizne lokacije reakcija.
Drugi metod, nazvan ABPP usmeren na cistein, tačno je odredio gde se stereosonde vezuju za proteine. Ovo je omogućilo timu da „zumira“ određeni džep za proteine i ispita da li je cistein u njemu reagovao sa stereosondama, slično fokusiranju na jedno mesto na tabli slagalice da bi se videlo da li se određeni komad uklapa.
Svaki molekul stereosonde ima dve glavne komponente: vezujući deo i elektrofilni deo. Jednom kada komponenta za vezivanje prepozna džep proteina ćelije raka, nadamo se da će molekul stereosonde moći da uđe – kao kako ključ treba da stane u bravu. Kada stereosonda ostane u džepu koji je kritičan za funkciju ćelije raka, ona blokira vezivanje proteina za druge proteine – na kraju sprečava podelu ćelije.
„Ciljanjem na ove veoma specifične faze u ćelijskom ciklusu, postoji potencijal da se uspori rast ćelija raka“, kaže Njomen. „Ćelija raka bi ostala u skoro stanju dve ćelije, a imuni sistem vašeg tela bi je otkrio kao neispravnu i usmerio je da umre.
Identifikovanje preciznih proteinskih regiona koji su kritični za preživljavanje ćelija raka moglo bi pomoći istraživačima da razviju ciljanije tretmane za zaustavljanje razmnožavanja ćelija.
Među ostalim ključnim nalazima tima je potvrda da je njihov dvostruki pristup dao tačniju sliku reaktivnosti protein-stereosonde od jedne metode.
„Uvek smo znali da obe metode imaju svoje nedostatke, ali nismo tačno znali koliko je informacija izgubljeno korišćenjem samo jedne tehnike“, kaže Njomen. „Bilo je iznenađujuće videti da je značajan broj proteinskih ciljeva promašen kada smo koristili jednu platformu preko druge.“
Tim se nada da će njihovi nalazi jednog dana informisati o novim terapijama raka koje ciljaju ćelijsku deobu. U međuvremenu, Njomen želi da dizajnira nove biblioteke stereosonda kako bi otkrio proteinske džepove koji su umešani u bolesti izvan raka, uključujući inflamatorne poremećaje.
„Mnogi proteini su umešani u bolesti, ali mi nemamo stereosonde da ih istražimo“, rekla je ona. „Napred, želeo bih da pronađem više proteinskih džepova koje možemo da proučavamo u svrhe otkrivanja lekova.“