Delimično zahvaljujući veličini atoma, naelektrisana varijacija zlata koja se zove Au 2+ ne nalazi se obično u prirodi.
Naučnici sa Univerziteta Stanford, Univerziteta Kalifornije, Berkli i Univerziteta McGill u Kanadi su sada uspeli da stvore i stabilizuju retki jon, omogućavajući niz novih upotreba za ovaj fascinantni elementarni metal.
Atomi zlata imaju mnogo protona spakovanih u jezgra, dajući im veliko pozitivno naelektrisanje koje snažno vuče njihove elektrone u orbiti. Ove neobično jake sile čine efekte specijalne relativnosti na njihovo ubrzanje daleko značajnijim, čineći neke rasporede elektrona verovatnijim od drugih.
Ne samo da ova relativistička konfiguracija daje zlatu žućkasti sjaj, već čini gubitak jednog ili tri elektrona verovatnijim od gubitka dva.
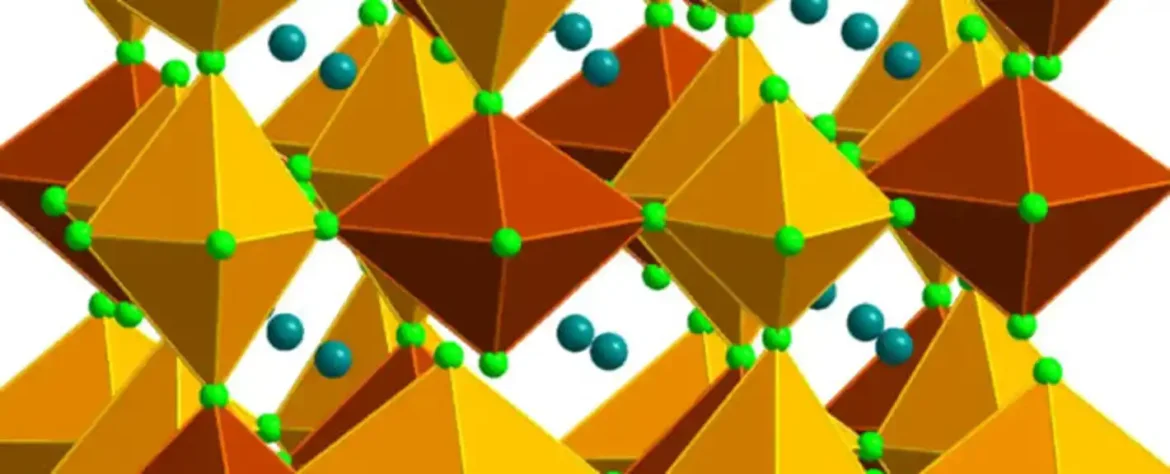
Ovde su hemičari uhvatili zlatne jone u vrstu kristalnog materijala zvanog halid perovskit, koji se koristi svuda od solarnih panela do elektronskih uređaja.
Posebna konfiguracija elemenata u kristalu stabilizovala je sve Au 2+ jone koji su se formirali unutar njegove matrice, efikasno čuvajući njihovo jedinstveno stanje.
„Halid perovskiti poseduju zaista atraktivna svojstva za mnoge svakodnevne primene, tako da smo tražili da proširimo ovu porodicu materijala“, kaže hemičar Kurt Lindkvist, ranije na Univerzitetu Stanford, a sada na Univerzitetu Prinston.
„Au 2+ perovskit bez presedana mogao bi da otvori neke intrigantne nove puteve.“
Otkrivena kao deo odvojenog istraživanja magnetnih poluprovodnika i kako bi oni mogli da poboljšaju elektronske uređaje, formula uključuje mešavinu soli cezijum hlorida, Au 3+ hlorida, vode, hlorovodonične kiseline i „malo vitamina C“.
„U laboratoriji možemo napraviti ovaj materijal koristeći veoma jednostavne sastojke za oko pet minuta na sobnoj temperaturi“, kaže Lindkvist.
„Završimo sa prahom koji je veoma tamnozelen, skoro crn, i iznenađujuće je težak zbog zlata koje sadrži.
Donirajući jedan od svojih elektrona, vitamin C transformiše Au 3+ jon u Au 2+. Brojne analize potvrdile su da su naučnici zaista proizveli ovo najređe zlatno stanje u stabilnom obliku.
Zlato je atraktivan element iz mnogo razloga, pored njegove prilično privlačne boje: relativno ga je lako preoblikovati, ali ne reaguje lako sa drugim hemikalijama, što znači da ne tamni i ne degradira tokom vremena.
Sada imamo novi, stabilan oblik koji treba da iskoristimo, sledeći koraci su da se pažljivije sagledaju optičke i elektronske karakteristike Au 2+, karakteristike koje bi eventualno mogle da se podese i koriste u elektronici i drugim oblastima.
„Bilo je pravo iznenađenje što smo uspeli da sintetišemo stabilan materijal koji sadrži Au 2+ – nisam ni verovao u to u početku“, kaže hemičar Hemamala Karunadasa sa Univerziteta Stanford.