Sve žive ćelije vrve ribonukleinskom kiselinom (RNK), molekulima koji prenose genetske poruke kako bi ćelije funkcionisale. Ali ovi neophodni molekuli takođe mogu pokrenuti ćelijske alarme. Na primer, dugi uvrnuti lanci RNK u virusima su signalni znak napadača i ljudski imuni sistem izaziva upalu u njihovom prisustvu.
Na početku svoje istraživačke karijere, dr Hačung Čung se pitala kako imuni sistem može da napravi razliku između virusne RNK koja izaziva bolest i naše normalne RNK. Sada, to pitanje je dovelo njeno istraživanje u iznenađujućem pravcu – proučavanje moždanih bolesti uključujući Alchajmerovu bolest, amiotrofičnu lateralnu sklerozu (ALS) i lupus moždanu maglu. Čungovi najnoviji rezultati sugerišu da je za hroničnu upalu u ovakvim stanjima možda krivo pogrešno sensiranje naše sopstvene RNK u mozgu.
„Mislim da su neurodegenerativne bolesti poslednja granica biomedicine gde je razvoj terapije bio zbunjujući i spor“, kaže Chung, docent za mikrobiologiju i imunologiju na Vagelos koledžu lekara i hirurga. „Mislim da bi za mnoge od ovih bolesti, ako možemo da iskoristimo imuni sistem na pravi način, mogli bismo da vidimo napredak.
Naučnici odavno znaju da imuni molekuli odgovorni za prepoznavanje virusa, poznati kao receptori za prepoznavanje uzoraka, mogu otkriti virusne dvolančane RNK strukture, koje se formiraju kada se dva komplementarna RNK lanca povežu zajedno.
Kao postdoktorski saradnik, Chung je u početku proučavao da li enzim ADAR1 koji modifikuje RNK može da cilja virusne dsRNA i da promeni tok virusne infekcije. Međutim, otprilike u isto vreme, drugi istraživač je otkrio da mutacije koje ometaju funkciju ADAR1 uzrokuju autoimunu bolest Aicardi-Goutijeresov sindrom (AGS), u kojoj imuni sistem napada zdrave moždane ćelije.
Ti iznenađujući nalazi sugerišu da ADAR1 nije važan samo u virusnoj infekciji, već je bio kritičan za održavanje biološkog mira u telu na druge načine.
„Mislio sam da je zaista interesantno da bi nepostojanje ovog proteina za uređivanje RNK odjednom izazvalo tako ozbiljne simptome u mozgu, čak i kada nije bilo virusa u blizini“, priseća se Chung. „Zaista me je zainteresovalo šta protein radi da bi nas održao zdravim odvojeno od njegove uloge u infekciji virusom.“
Chung, koji je tada radio sa mentorom Čarlsom Rajsom na Univerzitetu Rokfeler, otkrio je da modifikacije posredovane ADAR1 napravljene na našim dvolančanim RNK molekulima sprečavaju receptore za prepoznavanje obrazaca od stalnog pokretanja upale u zdravim tkivima. Tim je prijavio svoje nalaze u Cell-u 2018.
Taj nalaz je zadovoljio neke od Čungove radoznalosti o tome kako receptori za prepoznavanje obrazaca izbegavaju označavanje zdrave ljudske RNK, ali pitanja je i dalje bilo puno.
„Još uvek ne znamo tačno kako ADAR1 radi da sakrije ljudsku RNK od receptora za prepoznavanje obrazaca“, kaže Chung. „Mislimo da bi to moglo da napravi malo pregiba u RNK dupleksu, što otežava pronalaženje pomoću receptora za prepoznavanje obrazaca.“
Chungovo istraživanje ADAR1 nastavilo se kada je pokrenula sopstvenu istraživačku laboratoriju u Kolumbiji 2019. Želela je da sazna zašto su simptomi AGS-a uglavnom u mozgu, kada se RNK nalazi u celom telu. Ako mutacije u ADAR1 čine da imuni sistem prepozna RNK u mozgu i izazove upalu, zašto to nije izazvalo i slične visoke nivoe zapaljenja u srcu, jetri, krvi i drugde?
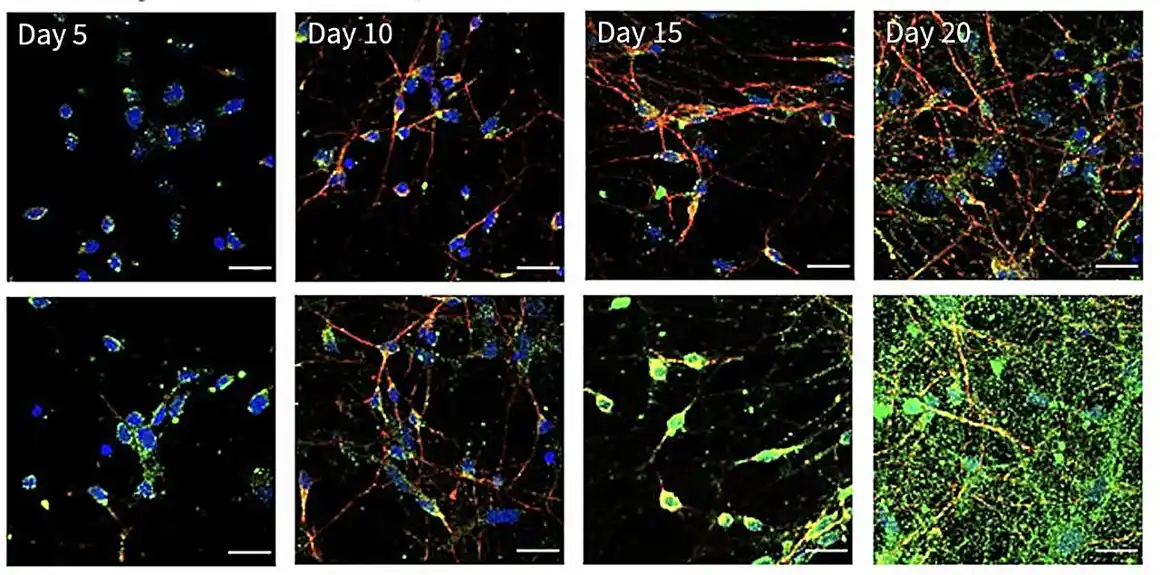
U njenoj najnovijoj studiji, objavljenoj u Science Immunologi u oktobru 2023., dva člana Chung laboratorije, Tiler Dorriti, dr, i Heegvon Shin, Ph. a oni bez ADAR1 da se razviju u neurone i druge tipove ćelija. Otkrili su da neuroni, u poređenju sa drugim ćelijama, imaju daleko duže dvolančane RNK strukture poput onih koje se nalaze u virusima.
Bez ADAR1, većina ćelija je imala samo male količine dvolančane RNK da bi se receptori za prepoznavanje obrazaca označili kao opasni. Neuroni su, s druge strane, imali mnogo. Bez ADAR1 da prikrije RNK, receptori za prepoznavanje obrazaca su odmah pokrenuli upalu u neuronima. Zauzvrat, ta upala može povećati nivoe receptora za prepoznavanje obrazaca, pogoršavajući odgovor u ciklusu koji se teško zaustavlja.
„Jednom kada dobijete ovaj početni skok u zapaljenju, bilo da je to posledica virusa ili autoimune reakcije, možete se zaključati u ovu petlju gde receptori za prepoznavanje obrazaca nastavljaju da pronalaze RNK, a zatim pravite više receptora za prepoznavanje obrazaca“, kaže Chung.
Ovo verovatno objašnjava šta se dešava u mozgu ljudi sa AGS-om, ali takođe nagoveštava mogući mehanizam za upalu koja se teško zaustavlja u uslovima kao što su lupusna magla mozga, ALS i Alchajmerova bolest.
Da bi pokušao da se bori protiv upale u njihovim izolovanim neuronima, Chungov tim je smanjio nivoe slobodno plutajuće, dvolančane RNK u ćelijama. Iako je ovo smanjilo upalu, dovelo je i do još jednog iznenađenja: neuroni su odjednom postali podložniji infekcijama virusom Zika i herpes simpleks virusom.
„Shvatili smo da je zapravo važno da vaši neuroni imaju ovu upalu niskog nivoa“, kaže Chung.
Ova manja upala izazvana RNK u mozgu preuzima ulogu pilot lampe na šporetu – održava imuni sistem aktiviranim i spremnim da brže reaguje kada dođe do napada virusa, pretpostavlja ona.
„U udžbenicima smo naučili da receptori za prepoznavanje obrazaca sede okolo i čekaju patogene“, kaže Čung. „Ali naše istraživanje počinje da sugeriše da možda ovi molekuli uvek osećaju neku našu sopstvenu RNK i drže upalu uključenom na veoma niskom nivou.“
Umesto da bude obeshrabrena svim iznenađenjima u njenoj najnovijoj studiji, Chung je više nego ikada motivisana da razume složenu interakciju između RNK i imunoloških odgovora u mozgu – i drugde.
„Nauka stvara zavisnost“, kaže ona. „Volim te ponižavajuće trenutke u kojima je vaš eksperiment funkcionisao, ali vam je dao potpuno drugačije rezultate nego što ste očekivali. To samo dokazuje da postoji još mnogo toga za razumevanje.“