Nova solvatohromna sonda mogla bi da pomogne u rasvetljavanju odnosa između fluidnosti lipidnih membrana i različitih ćelijskih funkcija, izveštavaju naučnici sa Tokijskog tehnološkog instituta i Univerziteta Kjušu. Zahvaljujući inovativnom dizajnu, predložena sonda nudi izuzetnu stabilnost, nisku toksičnost i izuzetna fluorescentna svojstva, što omogućava vizuelizaciju promena u redosledu lipidnih membrana u realnom vremenu tokom složenih procesa, kao što je deoba ćelija.
Nalazi su objavljeni u časopisu Napredna nauka.
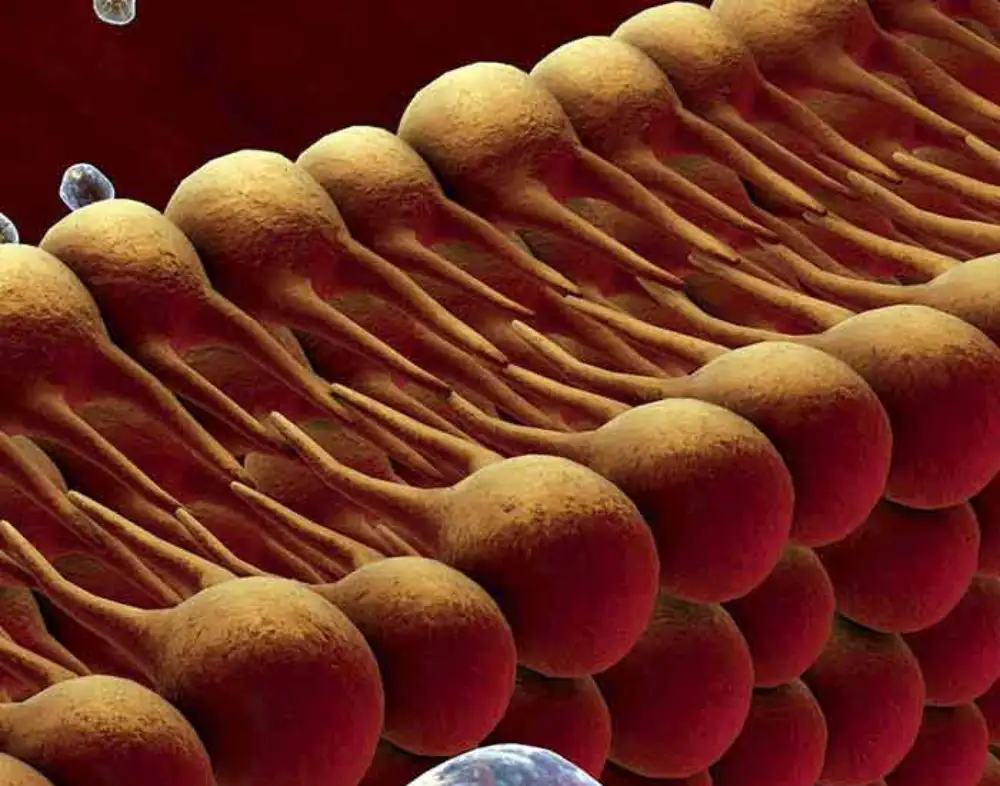
Lipidne membrane su više od obične barijere koje odvajaju ćelije i organele od njihovog okruženja. Oni takođe igraju ključnu ulogu u nekoliko ćelijskih funkcija, kao što su kretanje ćelija, razmena materijala, upravljanje otpadom i sensing.
Uopšteno govoreći, lipidne membrane postižu ove podvige uz pomoć proteina i drugih molekula, koji su složeno integrisani u strukturu membrane, često menjajući njenu fluidnost ili red. Shodno tome, proučavanje reda lipidnih membrana je važno podpolje u ćelijskoj biologiji, ne samo zato što mnoge bolesti mogu izazvati ili biti uzrokovane abnormalnostima u redu lipidnih membrana.
Da bi vizuelizovali fluidnost lipidnih membrana, naučnici obično koriste fluorescentne supstance poznate kao solvatohromne sonde ili boje. Izraz „solvatohrom“ znači da svetlost koju emituje molekul menja boju u zavisnosti od polariteta okolnog okruženja.
Dakle, kada se unese u lipidnu membranu, boja koju emituju ove boje zavisi od reda lipidnih membrana, koji je usko povezan sa polaritetom. Međutim, konvencionalne solvatohromne boje suočavaju se sa nekoliko izazova, uključujući nisku stabilnost, niske fluorescentne emisije, toksičnost ćelija i oslanjanje na ultraljubičasto svetlo kao izvor ekscitacije.
U studiji, istraživački tim sa Tokijskog instituta za tehnologiju i Univerziteta Kjušu, Japan, pokušao je da prevaziđe sve ove prepreke. Istraživačka grupa, koju su predvodili vanredni profesor Gen-ichi Konishi sa Tokio Tech-a i profesor Junichi Ikenouchi sa Univerziteta Kiushu, razvila je novu solvatohromnu boju koja bi mogla revolucionirati snimanje reda lipida u realnom vremenu.
Da bi razvio svoju novu sondu, tim je prvo istražio i uporedio fotofizička svojstva nekoliko različitih boja. Nakon nekih pokušaja i grešaka, odlučili su se za određeni molekularni dizajn koji je ispunio sva njihova očekivanja. Konačna verzija sonde, 2-N,N-dietilamino-7-(4-metoksikarbonilfenil)-9,9-dimetilfluoren (FπCM), uključivala je planarnu strukturu koja se sastoji od dela donora elektrona i dela akceptora elektrona spojenih zajedno π-most. Ova konfiguracija je olakšala intramolekularni prenos naelektrisanja, koji je od suštinskog značaja za definisanje solvatohromnih i fluorescentnih svojstava molekula.
Istraživači su procenili učinak predložene boje kroz sveobuhvatan niz eksperimenata. FπCM je pokazao izuzetna fluorescentna svojstva i izuzetnu hemijsku stabilnost ne samo u rastvaračima i veštačkim lipidnim membranama, već iu fiziološkim uslovima u živim ćelijama.
Jedan od najatraktivnijih aspekata predložene boje bila je njena dugoročna fotostabilnost, kao što dr Koniši primećuje: „U našim eksperimentima, FπCM bi mogao da opstane oko pet sati, dok bi Prodan i Laurdan, dve dobro utvrđene solvatohromne boje, bile potpuno ugašen za otprilike 30 minuta. Činjenica da smo koristili relativno intenzivnu konfokalnu lasersku svetlost sugeriše da bi FπCM takođe bio otporan na intenzivnu svetlost koja dolazi iz različitih uređaja.“
Posebno, tim je mogao uspešno da posmatra fluidnost lipidnih membrana tokom čitavog procesa ćelijske deobe, što implicira da je FπCM netoksičan, za razliku od drugih najsavremenijih solvatohromnih boja. Štaviše, predložena sonda se može lako modifikovati da proizvodi FπCM derivate koji ciljaju na specifične lipidne membrane, kao što su one koje se nalaze u ćelijskim organelama kao što su mitohondrije i endoplazmatski retikulum.
„Verujemo da će istraživanje korelacije između aktivacije membranskih proteina kao odgovora na stimuluse i prostorno-vremenskih prelaza fluidnosti membrane baciti svetlo na mehanizme koji leže u osnovi različitih funkcija membrane“, zaključuje dr Koniši. „Pošto se živo snimanje sa FπCM i derivatima specifičnim za organele može lako izvesti konvencionalnim konfokalnim mikroskopima, membranski red bi mogao postati standardni, široko dostupan izvor informacija za ćelijske biologe.“
Uz malo sreće, izuzetna svojstva FπCM će pomoći biolozima da otkriju tajne iza unutrašnjeg rada ćelija.