Istraživači sa Univerziteta u Torontu Tanz centra za istraživanje neurodegenerativnih bolesti koristili su nove tehnike da otkriju koji podtipovi moždanih ćelija izražavaju genetski materijal koji proizvodi tau, ključni protein uključen u razvoj progresivne supranuklearne paralize neurodegenerativne bolesti (PSP).
Studija, objavljena nedavno u časopisu Acta Neuropathologica, sugeriše da dvosmerni pristup lečenju koji cilja dva ključna mehanizma u razvoju bolesti može biti efikasniji od trenutnih metoda.
„Ova studija koristi novu metodologiju da pokaže da glijalne ćelije – potporno moždano tkivo – mogu same da proizvedu tau i postanu bolesne bez preuzimanja taua iz nervnih ćelija. Stoga su glijalne ćelije važnije u patogenezi bolesti nego što se ranije pretpostavljalo“, kaže Gabor Kovač, istraživač u Tanz centru i profesor na Katedri za laboratorijsku medicinu i patobiologiju Medicinskog fakulteta Temerti.
„Ova studija takođe pokazuje da se RNK ekspresija taua, dakle proizvodnja taua, čuva tokom bolesti i obezbeđuje kontinuirano snabdevanje tau, što treba imati na umu u razvoju terapije.“
Jedna od najčešćih karakteristika neurodegenerativnih bolesti kao što su PSP i Alchajmerova bolest je akumulacija pogrešno savijenog tau proteina u neuronima i njihovim potpornim ćelijama, što narušava funkciju ovih ćelija.
Istraživači su dugo raspravljali o tome koje moždane ćelije izražavaju gen MAPT, koji kodira tau. Decenijama je dominantan stav bio da neuroni eksprimiraju MAPT RNK, ali glijalne ćelije ne.
Šeli Forest, neuropatolog i naučni saradnik Kovačsovog tima, kaže da su neuropatolozi primetili da glijalne ćelije sadrže tau agregate, ali nije bilo čvrstih dokaza o tome odakle dolazi.
„U ovim neurodegenerativnim bolestima nalazimo patološke tau agregate u gliji, tako da je uvek postojala aktivna debata o tome zašto se tau patologija akumulira u gliji, i da li je proizvode neuroni i preuzimaju glija ili da li glija može sama da je napravi“, kaže Forest.
Istraživački tim, koji je uključivao saradnike u Australiji i Dubaiju, pregledao je uzorke moždanog tkiva tri pacijenta koji su imali PSP i tri koji nisu. Pristup ovim uzorcima post-mortem pacijenata – koje Forest opisuje kao „najvelikodušniji poklon koji svako može dati“ – omogućio je istraživačima da imaju potpuniji i realističniji pogled na ekspresiju RNK u različitim tipovima moždanih ćelija u poređenju sa korišćenjem životinjskih modela ili ćelijske kulture.
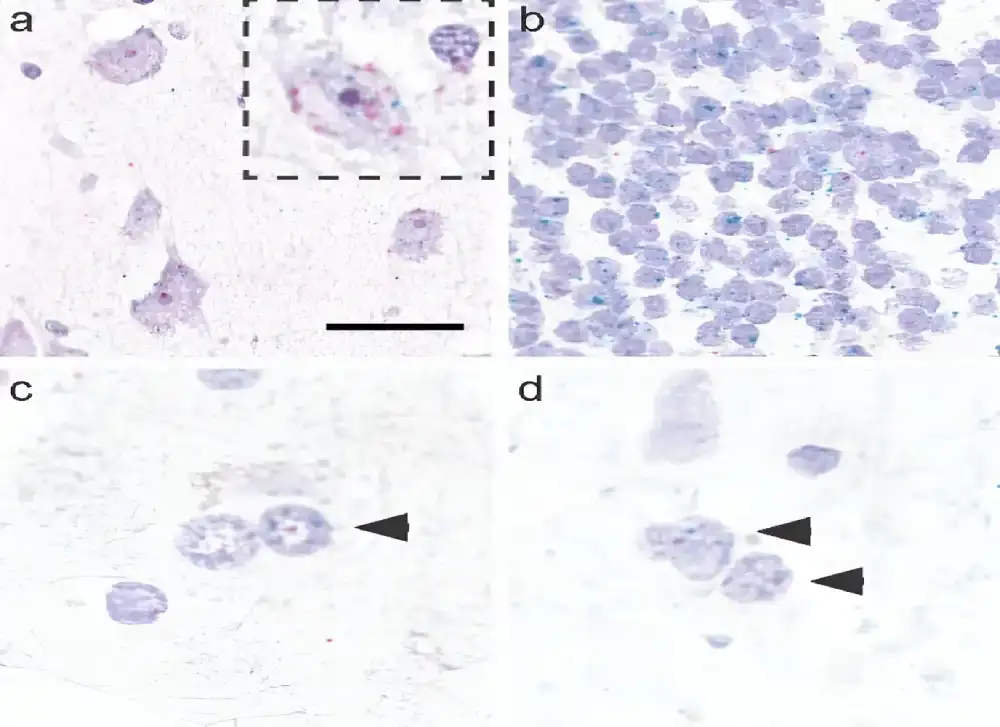
Tim je koristio inovativnu tehnologiju RNAscope za vizuelizaciju RNK molekula pod mikroskopom, kao i sekvenciranje RNK sa jednim jezgrom, kako bi mapirao ekspresiju RNK u različitim regionima mozga i različitim tipovima moždanih ćelija. Uzorci pacijenata u kombinaciji sa novom tehnologijom omogućili su istraživačima da po prvi put vizualizuju gde se MAPT RNK izražava u mozgu.
Tim je otkrio da se različiti regioni mozga i moždane ćelije razlikuju u količini MAPT RNK koju izražavaju. I, što je još važnije, identifikovali su da glijalne ćelije zaista eksprimiraju MAPT RNK – pružajući prve čvrste dokaze o njenom prisustvu u ovim ćelijama. To znači da glijalne ćelije ne samo da preuzimaju pogrešno savijeni tau proizveden od neurona, već ga i same prave.
„Dugo smo imali tu sumnju, ali sada smo uspeli da dobijemo dokaze koji bi pokazali da je to slučaj“, kaže Forest. „Kako i zašto se tau akumulira u gliji u PSP nije sasvim jasno, ali naša studija ističe dva nova mehanička puta za prenos od ćelije do ćelije pogrešno savijenog taua i akumulacije u mozgu, što je uzbudljiv rezultat.“
Rezultati studije sugerišu da bi dvosmerni pristup terapiji – usmeren na pogrešno savijeni tau protein i ekspresiju MAPT RNK – mogao biti najbolja strategija za lečenje PSP i sličnih bolesti.
„Zato što predlažemo dva različita puta za patogenezu bolesti, ako se fokusirate samo na jedan, dobijate samo polovinu slike“, kaže Forrest. „Ako blokirate jedan put, on će samo nastaviti sa drugim putem. Morate blokirati oba.“
Kovačev tim će sada koristiti slične tehnike za proučavanje ovog istog pitanja kod drugih neurodegenerativnih bolesti. Oni će takođe pratiti svoje rezultate kako bi razumeli ekspresiju RNK u različitim regionima mozga.
„Naš tim je jedan od prvih koji koristi ove tehnike u uzorcima neurodegenerativno obolelog ljudskog mozga. Sada ćemo proširiti ovo ispitivanje na druge obolele proteine i mapirati kako promene u ekspresiji tau RNK utiču na ekspresiju ključnih gena na ćelijskom nivou, fokusirajući se na glijalnim ćelijama“, kaže Kovač.
„Na kraju, ovaj rad će informisati osnovne istraživače da se fokusiraju na glijalne ćelije — ne samo na neurone — kada pokušavaju da razotkriju patogenezu PSP-a, i informisaće programere terapije da ne samo da uklone pogrešno savijeni tau kao što trenutno rade, već i da smanje proizvodnju normalnog tau koristeći terapije zasnovane na RNK.“