Utvrđeno je da je aktivnost neurona u mozgu sisara povezana sa različitim fiziološkim procesima, uključujući protok krvi koji im obezbeđuje energiju potrebnu za funkcionisanje (tj. cerebralni protok krvi). Ova bliska veza između moždanih ćelija i krvnih sudova poznata je kao neurovaskularna sprega (NVC).
Poremećaji ili promene ovog odnosa često su primećeni kod pacijenata sa dijagnostikovanim različitim neuropatologijama i neurodegenerativnim oboljenjima. Na primer, smanjeni NVC je povezan i sa Alchajmerovom bolešću i sa moždanim udarom, od kojih oba mogu biti jako oštećena, pa čak i opasna po život.
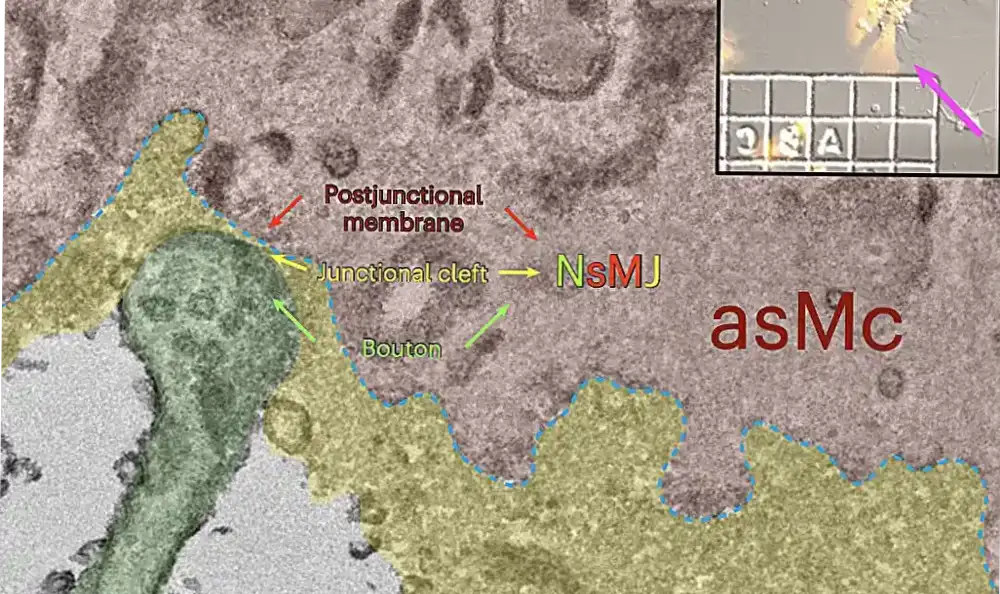
Istraživači sa Univerziteta Vestlejk, Instituta za napredne studije Vestlejk i drugih instituta u Kini nedavno su sproveli studiju sa ciljem boljeg razumevanja bioloških i neuronskih procesa koji podržavaju NVC. Njihov rad, objavljen u časopisu Nature Neuroscience, otkrio je mehanizam prenosa sličan sinaptičkom i koji izgleda da pokreće NVC, koji se javlja između neuralno-arteriolarnih spojeva glatkih mišićnih ćelija (NsMJ), koji su spojevi koji povezuju neurone i glatke mišiće arteriola.
„Iako je specifičnost tipa ćelije uključena u NVC, način na koji se aktivna neuronska informacija prenosi do ciljanih arteriola u mozgu ostaje slabo shvaćeno“, pišu Dongdong Zhang, Jiaiu Ruan i njihove kolege u svom radu. „Koristeći dvofotonsku fokalnu optogenetiku u moždanoj kori miša, pokazali smo da pojedinačni glutamatergični aksoni proširuju svoje inervirajuće arteriole preko sinaptičkog prenosa između spojeva neuralno-arteriolarnih ćelija glatkih mišića.“
Da bi dalje ispitali procese koji podržavaju NVC, Zhang, Ruan i njihove kolege analizirali su podatke prikupljene kombinacijom najsavremenijih tehnologija i optogenetskih tehnika, uključujući korelativnu svetlosnu elektronsku mikroskopiju (CLEM), RNK sekvenciranje, imunogold EM, snimanje kalcijuma i jedan akson optogenetika. Ovi alati su im zajedno omogućili da pomno proučavaju kako neuroni doprinose cerebralnom protoku krvi.
Istraživači su prvo identifikovali različite tipove NsMJ struktura i neurotransmiterskih receptora izraženih u ćelijama glatkih mišića arteriola. Takođe su pokazali da se funkcionalni NMDA receptori, koji moduliraju ekscitatorni neurotransmiter glutamat uključen u sinaptičku plastičnost i različite ključne kognitivne funkcije, mogu naći u ćelijama glatkih mišića miša, primata i ljudskih arteriola.
„Presinaptički bouton roditelj-ćerka pravi dvostruke inervacije na postsinaptičkim dendritima i na ćelijama glatkih mišića arteriola (aSMC), koje eksprimiraju mnoge tipove neuromedijatorskih receptora, uključujući nizak nivo podjedinice glutamatnog NMDA receptora 1 (Grin1)“, objašnjavaju istraživači u njihov papir.
„Poremećaj transmisije NsMJ aSMC-specifičnim nokautom GluN1 smanjio je optogenetsku i funkcionalnu hiperemiju izazvanu stimulacijom brkova. Posebno, odsustvo GluN1 podjedinice u aSMCs je izazvalo atrofiju mozga nakon cerebralne ishemije sprečavanjem preopterećenja Ca 2+ arteriolarnom konstrikcije u aSMCs širenje depolarizacije izazvane ishemijom.“
U suštini, Zhang, Ruan i njihove kolege su otkrili da je genetska manipulacija ovim NMDA receptorima u ASMC miševa rezultirala smanjenim sužavanjem krvnih sudova (tj. vazokonstrikcija) i olakšala njihov oporavak nakon što su pretrpeli ishemijski moždani udar. Sve u svemu, njihovi rezultati sugerišu da mehanizam prenosa koji su otkrili igra ključnu ulogu u NVC-u.
„Naši nalazi otkrivaju da NsMJ prenos pokreće NVC i otvara novi put za proučavanje moždanog udara“, pišu Zhang, Ruan i njihove kolege.
Ova studija bi uskoro mogla da otvori put za nova istraživanja koja istražuju potencijalnu ulogu prenosa između neuralnih aksona i otkrivenih ASMC i ishemijskih moždanih udara. Pored toga, mogao bi da podstakne razvoj novih tretmana kako bi se sprečilo širenje oštećenja izazvanih ishemijskim moždanim udarom i olakšalo oporavak obolelih pacijenata.