Bakterijski enzim nazvan histidin kinaza je obećavajuća meta za nove klase antibiotika. Međutim, bilo je teško razviti lekove koji ciljaju ovaj enzim, jer je to „hidrofobni“ protein koji gubi strukturu kada se ukloni sa svoje normalne lokacije u ćelijskoj membrani.
Sada je tim predvođen MIT-om pronašao način da enzim učini rastvorljivim u vodi, što bi moglo omogućiti brzi pregled potencijalnih lekova koji bi mogli da ometaju njegove funkcije.
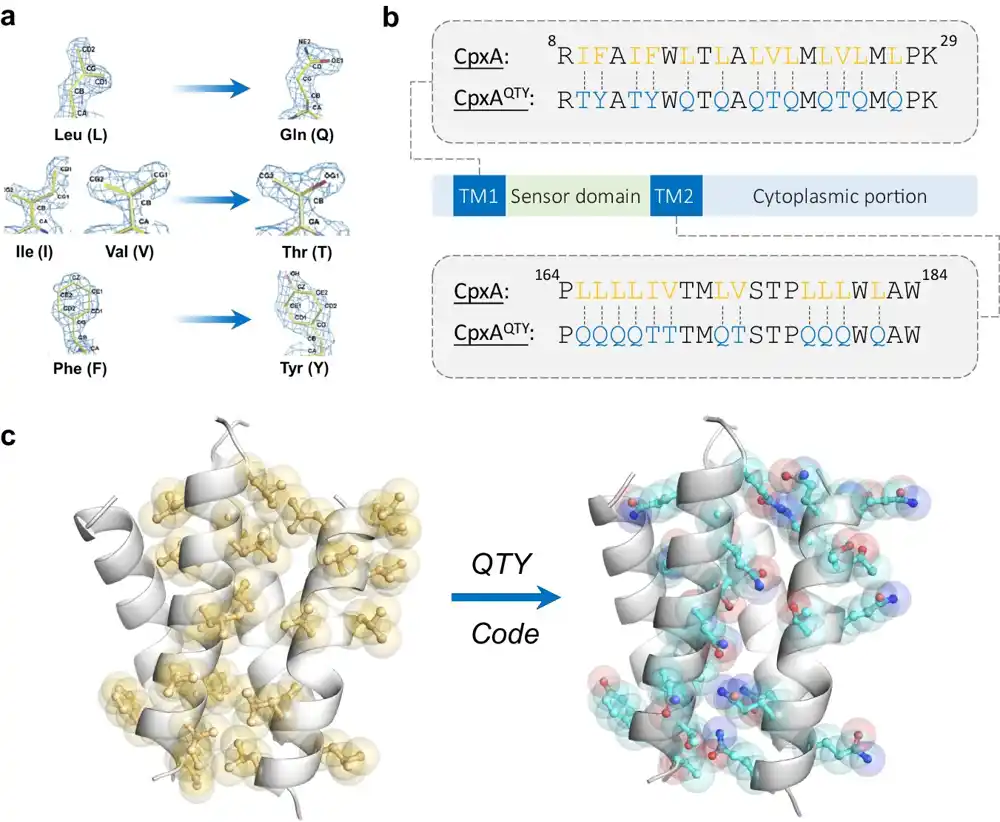
Istraživači su stvorili svoju novu verziju histidin kinaze zamenom četiri specifične hidrofobne aminokiseline sa tri hidrofilne. Čak i nakon ove značajne promene, otkrili su da je verzija enzima rastvorljiva u vodi zadržala svoje prirodne funkcije.
Nema postojećih antibiotika koji ciljaju histidin kinazu, tako da lekovi koji remete ove funkcije mogu predstavljati novu klasu antibiotika. Takvi kandidati za lek su preko potrebni za borbu protiv rastućeg problema rezistencije na antibiotike.
„Svake godine više od milion ljudi umre od infekcija otpornih na antibiotike“, kaže Shuguang Zhang, glavni istraživač u MIT Media Lab-u i jedan od starijih autora nove studije. „Ovaj protein je dobra meta jer je jedinstven za bakterije, a ljudi ga nemaju.“
Ping Ksu i Fei Tao, oboje profesori na Šangajskom univerzitetu Jiao Tong, takođe su stariji autori rada, koji se pojavljuje u Nature Communications. Mengke Li, diplomirani student na Šangajskom univerzitetu Jiao Tong i bivši gostujući student na MIT-u, glavni je autor rada.
Mnogi proteini koji obavljaju kritične ćelijske funkcije ugrađeni su u ćelijsku membranu. Segmenti ovih proteina koji obuhvataju membranu su hidrofobni, što im omogućava da se povezuju sa lipidima koji čine membranu. Međutim, kada se jednom uklone sa membrane, ovi proteini imaju tendenciju da izgube svoju strukturu, što otežava njihovo proučavanje ili skrining na lekove koji bi mogli da ih ometaju.
U 2018, Zhang i njegove kolege osmislili su jednostavan način da pretvore ove proteine u verzije rastvorljive u vodi, koje održavaju svoju strukturu u vodi. Njihova tehnika je poznata kao KTI kod, za slova koja predstavljaju hidrofilne aminokiseline koje se ugrađuju u proteine. Leucin (L) postaje glutamin (K), izoleucin (I) i valin (V) postaju treonin (T), a fenilalanin (F) postaje tirozin (I).
Od tada, istraživači su demonstrirali ovu tehniku na različitim hidrofobnim proteinima, uključujući antitela, citokinske receptore i transportere. Ti transporteri uključuju protein koji ćelije raka koriste za pumpanje lekova za hemoterapiju iz ćelija, kao i transportere koje moždane ćelije koriste za premeštanje dopamina i serotonina u ćelije ili iz njih.
U novoj studiji, tim je pokušao da pokaže, po prvi put, da se KTI kod može koristiti za stvaranje enzima rastvorljivih u vodi koji zadržavaju svoju enzimsku funkciju.
Istraživački tim je odlučio da se fokusira na histidin kinazu delimično zbog njenog potencijala da bude meta antibiotika. Trenutno, većina antibiotika deluje tako što oštećuje zidove bakterijskih ćelija ili ometa sintezu ribozoma, ćelijskih organela koje proizvode proteine. Nijedan od njih ne cilja na histidin kinazu, važan bakterijski protein koji reguliše procese kao što su otpornost na antibiotike i komunikacija između ćelije.
Histidin kinaza može da obavlja četiri različite funkcije, uključujući fosforilaciju (aktiviranje drugih proteina dodavanjem fosfatne grupe u njih) i defosforilaciju (uklanjanje fosfata). Ljudske ćelije takođe imaju kinaze, ali one deluju na druge aminokiseline osim histidina, tako da lekovi koji blokiraju histidin kinazu verovatno ne bi imali nikakav efekat na ljudske ćelije.
Nakon što su koristili KTI kod za pretvaranje histidin kinaze u oblik rastvorljiv u vodi, istraživači su testirali sve četiri njene funkcije i otkrili da je protein i dalje u stanju da ih obavlja. To znači da bi se ovaj protein mogao koristiti u ekranima visoke propusnosti za brzo testiranje da li potencijalna jedinjenja leka ometaju bilo koju od tih funkcija.
Koristeći AlphaFold, program veštačke inteligencije koji može da predvidi strukture proteina, istraživači su generisali strukturu za svoj novi protein i koristili simulacije molekularne dinamike da bi istražili kako on reaguje sa vodom. Otkrili su da protein formira stabilizirajuće vodonične veze sa vodom, koje mu pomažu da zadrži svoju strukturu.
Takođe su otkrili da ako bi samo zamenili zakopane hidrofobne aminokiseline u transmembranskom segmentu, protein ne bi zadržao svoju funkciju. Hidrofobne aminokiseline se moraju zameniti u celom transmembranskom segmentu, što pomaže molekulu da održi strukturne odnose koji su mu potrebni za normalno funkcionisanje.
Zhang sada planira da isproba ovaj pristup na metan monooksigenazi, enzimu koji se nalazi u bakterijama i koji može da pretvori metan u metanol. Verzija ovog enzima rastvorljiva u vodi bi se mogla prskati na mestima oslobađanja metana, kao što su štale u kojima žive krave, ili odmrzavanje permafrosta, pomažući da se ukloni veliki komad metana, gasa staklene bašte, iz atmosfere.
„Ako možemo da koristimo isti alat, KTI kod, na metan monooksigenazi, i koristimo taj enzim za pretvaranje metana u metanol, to bi moglo da uspori klimatske promene“, kaže Zhang.
KTI tehnika bi takođe mogla pomoći naučnicima da saznaju više o tome kako se signali prenose transmembranskim proteinima, kaže Vilijam DeGrado, profesor farmaceutske hemije na Univerzitetu Kalifornije u San Francisku, koji nije bio uključen u studiju.
„Veliki je napredak biti u mogućnosti da napravimo funkcionalno relevantne proteine rastvorljive u vodi“, kaže DeGrado. „Važno pitanje je kako se signali prenose preko membrana, a ovaj rad pruža novi način pristupa tom pitanju.“