Nova studija koju su vodili naučnici sa Univerziteta Upsala i INRAE/Universite Paris-Saclai otkrila je da provirusni protein domaćin ZC3H11A igra ključnu ulogu u održavanju održivosti embriona tokom ranog razvoja. Studija je otkrila ranije nepoznatu funkciju ZC3H11A u zamršenom procesu embrionalnog rasta i naglašava njen uticaj na razvoj. Rad je objavljen u Zborniku Nacionalne akademije nauka.
Sa preko dvadeset hiljada gena u ljudskom telu, fiziološke funkcije mnogih gena ostaju neuhvatljive. Prethodna studija istog tima identifikovala je ZC3H11A (skraćeno kao ZC3) kao provirusni protein jer je neophodan za efikasan rast nekoliko humanih virusa koji se repliciraju nuklearnom bojom, kao što je HIV.
Dakle, ZC3 protein se pojavio kao obećavajući terapeutski cilj za razvoj antivirusnih agenasa protiv medicinski značajnih humanih virusa. U trenutnoj studiji, tim je otkrio dodatnu funkciju ZC3 tokom određene vremenske tačke u ranom rastu embriona kod miševa. Zanimljivo je da nakon brisanja ZC3 u tkivima odraslih miševa nisu primećeni očigledni defekti. Ovaj nalaz ukazuje da ZC3 ima različite uloge u zavisnosti od razvojne faze.
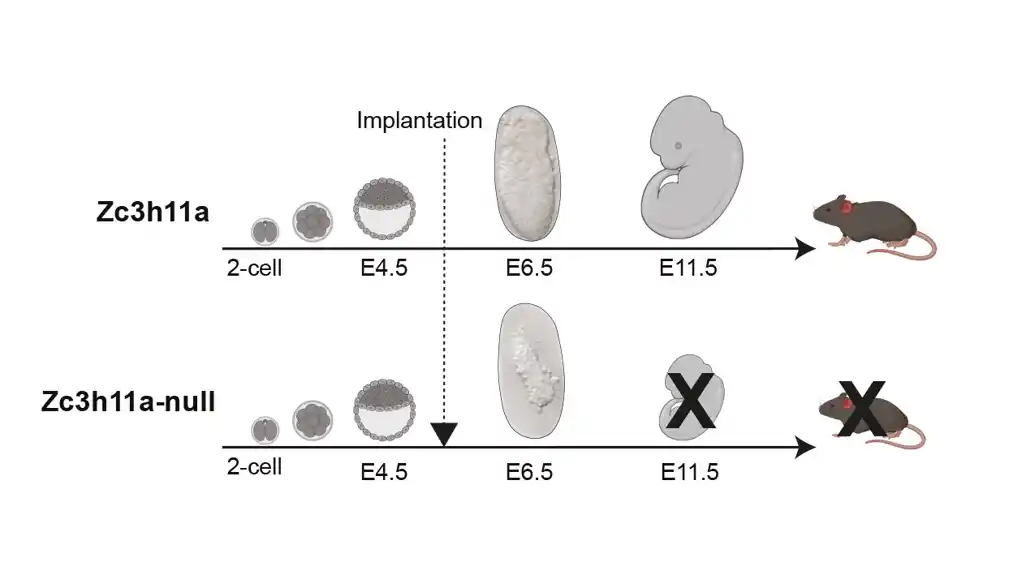
Sadašnja studija je pokazala da ZC3 igra ključnu ulogu u regulisanju ekspresije metaboličkih gena ključnih za metaboličke promene koje se dešavaju u embrionima oko implantacije. Poremećaj ili odsustvo ZC3 rezultira potpunom smrtnošću mišjih embriona i verovatno je da je inaktivacija ovog gena smrtonosna kod drugih sisara uključujući ljude. Ovaj nalaz naglašava neophodnu prirodu ZC3 u orkestriranju metaboličkih procesa neophodnih za opstanak i razvoj embriona.
„Cilj studije je bio da se uspostavi ZC3 model miša za proučavanje njegove uloge u replikaciji virusa. Bilo je iznenađujuće kada sam shvatio da mišji embrioni kojima nedostaje funkcionalni ZC3 gen nisu preživjeli“, objašnjava Shadi Iounis, koja je vodila studiju zajedno sa Leif Andersson sa Odeljenja za medicinsku biohemiju i mikrobiologiju Univerziteta u Upsali. „Zbog toga smo odlučili da proučimo embrione miša koji su izbili ZC3 u različitim razvojnim fazama kako bismo precizno odredili vreme u kojem ZC3 igra vitalnu ulogu.“
Koristeći RNK sekvenciranje i proteomske testove, istraživački tim je napravio značajno otkriće u vezi sa embrionima kojima nedostaje ZC3 pošto su primetili ozbiljne defekte u metaboličkoj regulaciji kod ovih embriona.
„Prikupili smo mišje embrione u ranim fazama trudnoće sa ciljem da pronađemo ZC3-null embrione za detaljnu karakterizaciju“, kaže Alis Jouneau, embriolog sa INRAE/Universite Paris-Saclai i koautor studije. „Uočili smo deo embriona koji pokazuje morfološke defekte. Naknadna genotipizacija DNK je potvrdila da ovim embrionima zaista nedostaje ZC3 gen.“
Neometani embrionalnom smrtnošću povezanom sa brisanjem ZC3, istraživači su počeli da proučavaju uticaj brisanja ZC3 na organe odraslih. Da bi to postigli, razvili su inducibilni model miša koji im je omogućio da nokautiraju ZC3 posebno nakon rođenja.
Rezultati ove studije otkrili su iznenađujući ishod, pošto potpuna inaktivacija ZC3 u tkivima miša nije pokazala nikakve primetne efekte na rast ili održivost ćelija. Činjenica da smanjenje ZC3 u tkivima odraslih nije rezultiralo bilo kakvim uočljivim kliničkim posledicama sugeriše da antivirusna terapija zasnovana na inaktivaciji ZC3 možda neće imati značajne neželjene efekte.
„ZC3H11A se ističe kao jedan od mnogih visoko konzerviranih gena među kičmenjacima, ali sa slabo opisanom funkcijom. Ova studija je rasvetlila funkcionalni značaj ZC3 kao jednog od faktora kritičnih za normalan razvoj embriona“, kaže Leif Andersson, profesor funkcionalnih nauka. Genomika na Univerzitetu u Upsali. „Činjenica da ZC3 nije kritičan za rast ćelija nakon rođenja, već za replikaciju višestrukih medicinski važnih virusa čini ga zanimljivom metom za razvoj novih antivirusnih terapija.“