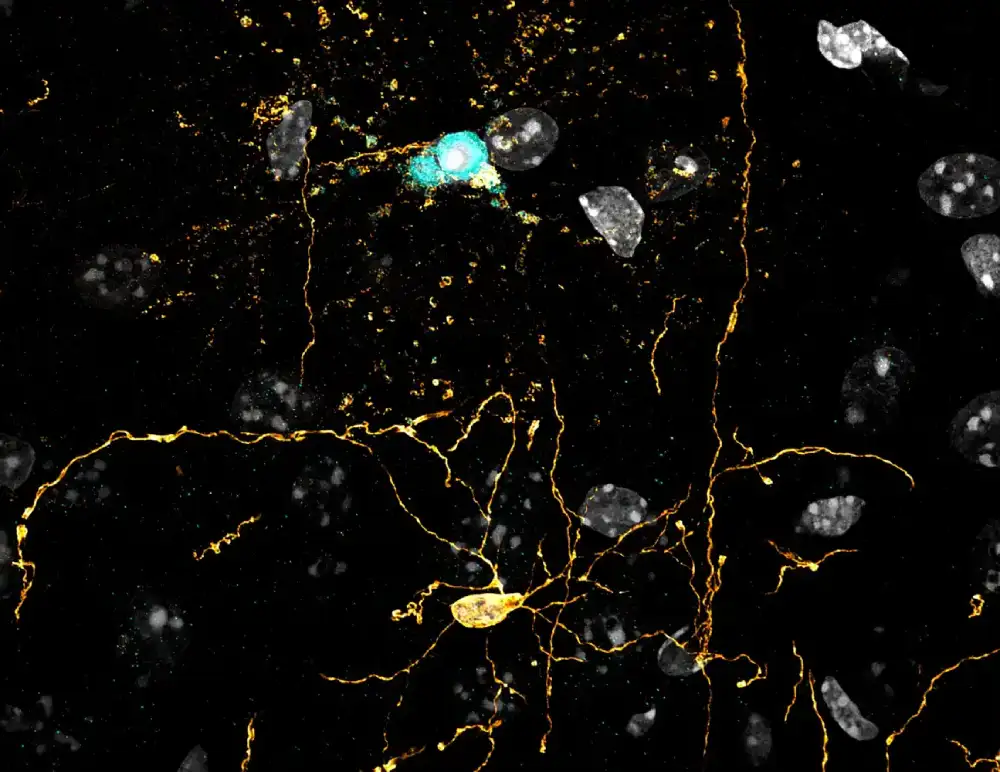
Za oligodendrocite — ćelije centralnog nervnog sistema kritične za funkcionisanje mozga — starost možda ne donosi mudrost, ali dolazi sa moći da se drže za život mnogo, mnogo duže nego što su naučnici znali. To je prema novoj studiji objavljenoj u Journal of Neuroscience.
Zrelim oligodendrocitima je trebalo šokantnih 45 dana da umru nakon fatalne traume koja je ubila mlađe ćelije u roku od očekivana 24 sata, izvještavaju istraživači iz Dartmoutha. Nalazi sugerišu da postoji novi put za napore da se preokrene ili spreči šteta koju starenje i bolesti kao što je multipla skleroza uzrokuju ovim važnim ćelijama.
U mozgu, oligodendrociti se omotavaju oko dugih, mršavih veza između nervnih ćelija poznatih kao aksoni, gde proizvode lipidnu membranu zvanu mijelinski omotač koji oblaže akson. Aksoni prenose električne signale koje nervne ćelije koriste za komunikaciju; mijelinski omotači – poput plastične prevlake na bakarnoj žici – pomažu da ovi signali putuju efikasnije.
Starost i neurodegenerativne bolesti poput MS oštećuju oligodendrocite. Kada ćelije umru, njihova proizvodnja mijelina nestaje sa njima, uzrokujući da se mijelinski omotači raspadaju bez ičega da ih nadoknade. Ovo može dovesti do gubitka motoričke funkcije, osećaja i pamćenja jer neuroni gube sposobnost komunikacije.
Naučnici su pretpostavili da oštećeni oligodendrociti — kao i sve povređene ćelije — pokreću ćelijsko samouništenje zvano apoptoza, u kojoj se ćelije ubijaju. Međutim, istraživači iz Dartmoutha otkrili su da zreli oligodendrociti mogu doživeti produženi život pre svoje smrti koji nikada ranije nije viđen. Nalazi postavljaju kritično pitanje šta se u ovim ćelijama menja kako sazrevaju što im omogućava da opstanu.
„Otkrili smo da zrele ćelije idu putem koji je još uvek kontrolisan, ali ne i klasičnim programiranim putem ćelijske smrti“, rekao je Robert Hil, docent bioloških nauka i odgovarajući autor rada.
„Mislimo da nam ovo pokazuje šta se dešava u mozgu dok starimo i otkriva mnogo o tome kako ove ćelije umiru kod starijih ljudi“, rekao je Hil. „Taj jedinstveni mehanizam je važan za nas da dalje istražujemo. Moramo da razumemo zašto ove ćelije slede ovaj put kako bismo ga potencijalno mogli podstaći ili sprečiti, u zavisnosti od konteksta bolesti.“
Prvi autor Timothi Chapman, koji je vodio projekat kao doktor nauka. kandidat u Hilovoj istraživačkoj grupi, rekao je da su napori da se razviju tretmani za očuvanje mijelina fokusirani na kultivaciju mladih oligodendrocita i zaštitu zrelih. Ali ova studija sugeriše da se ćelije mogu značajno promeniti kako stare i da tretman koji odgovara svima možda neće uspeti.
„Kao odgovor na istu stvar, mlade ćelije idu jednim putem, a stare ćelije drugim“, rekao je Chapman, koji je sada postdoktorski istraživač na Univerzitetu Stanford. „Ako želite da zaštitite stare ćelije, možda ćete morati da uradite nešto potpuno drugačije nego ako želite da pomognete mladim ćelijama da sazrevaju. Verovatno će vam trebati dvostruki pristup.“
Rad se zasniva na modelu živog tkiva koji je tim objavio u časopisu Nature Neuroscience u martu 2023. koji im omogućava da započnu smrt jednog oligodendrocita da bi posmatrali kako ćelije oko njega reaguju.
Izjavili su da kada oligodendrocit u mladom mozgu umre, ćelije oko njega odmah nadopune izgubljeni mijelin. U mozgu koji je ekvivalentan mozgu 60-godišnjaka, međutim, okolne ćelije nisu učinile ništa, a mijelin je izgubljen.
„Taj model nas približava što bliže procesu ćelijske smrti koji se dešava u mozgu“, rekao je Hil. „Mi smo u stanju da stvarno dobro modelujemo efekte starenja. Naša sposobnost da izaberemo jedan oligodendrocit, posmatramo kako umire i gledamo kako se regeneriše ili ne regeneriše omogućava nam da razumemo šta pokreće ovaj proces na ćelijskom nivou i kako može biti kontrolisan.“
Za najnoviju studiju, istraživači su koristili svoj model za smrtonosno oštećenje DNK oligodendrocita koristeći ono što predstavlja zrak ćelijske smrti – uređaj zasnovan na fotonu pod nazivom 2Phatal koji je razvio Hil. Takođe su koristili standardnu metodu za uklanjanje mijelina koja koristi toksin kuprizona na bazi bakra kao poređenje.
Kao što su prethodne studije izvestile, nezrele ćelije su brzo umrle. Ali starije ćelije su živele dalje, što je tim iz Dartmuta u početku protumačio kao otpornost na oštećenje DNK.
Studija je došla u fokus kada su istraživači ispitali zrele ćelije 45 dana kasnije koristeći dugotrajnu tehniku snimanja visoke rezolucije razvijenu u Hill laboratoriji. „Tada smo videli da ćelije nisu bile otporne na oštećenja – umesto toga su doživele ovu produženu ćelijsku smrt“, rekao je Hil.
„Niko nikada nije proveravao da li postoji ćelijska smrt tako dugo nakon oštećenja DNK. To je jedini primer koji možemo naći u literaturi gde ćelija doživi tako traumatičan događaj i ostane duže od nedelju dana“, rekao je on.
Pošto ljudi imaju oligodendrocite za ceo život, poznato je da ćelije akumuliraju oštećenje DNK i da su otpornije od drugih ćelija, rekao je Chapman. „Zato mislimo da je ovaj efekat primenljiv na starenje. Jedan od razloga zašto ove ćelije mogu opstati tako dugo je taj što su navikle da doživljavaju ovu vrstu oštećenja prirodno tokom starenja“, rekao je on.
Studija otvara prva vrata ogromnog lavirinta još pitanja, kažu Hil i Čepmen, poput toga da li je produžena smrt dobra stvar. To može biti ekvivalent disfunkcionalnom mijelinu, što je gore samo sedenje na aksonu nego da mijelina uopšte nema, rekao je Hil. On izoluje ćeliju od okolnog tkiva i u suštini gubi hranljive materije.
„Skoro kao da smeće leži na aksonu 45 dana. Da li želimo da sačuvamo to smeće ili da ubrzamo njegovo uklanjanje? Nismo ni znali da je to pitanje dok nismo videli ovo“, rekao je Hil.
„Ako razumemo mehanizam smrti ćelije, možda ga možemo ubrzati i osloboditi se tog disfunkcionalnog mijelina“, rekao je on. „Uvek pokušavamo da sačuvamo ćelije i sačuvamo tkivo, ali morate da znate da li su vredne spasavanja.“