Da bi se rešio globalni teret kardiovaskularnih bolesti, postoji hitna potreba za tehnologijama skrininga u ranoj fazi i efikasnim terapijskim sredstvima. Međutim, medicinska istraživačka zajednica se suočava sa značajnim izazovima, uključujući visoku stopu neuspeha lekova kandidata u kliničkim ispitivanjima i etičke brige oko upotrebe laboratorijskih životinja. Statički modeli ćelijske kulture takođe ne uspevaju u repliciranju složenog mikrookruženja na nivou tkiva.
Nedavna dostignuća u inženjerstvu tkiva i mikrofluidici utrla su put za razvoj modela srce na čipu. Ovi modeli imaju za cilj da simuliraju uloge kardiomiocita, fibroblasta i endotelnih ćelija — od kojih je svaki ključan za normalnu srčanu funkciju.
Kardiomiociti upravljaju kontrakcijom srca i električnom signalizacijom, fibroblasti održavaju strukturni integritet, a endotelne ćelije regulišu vaskularni sistem.
Prethodne studije su izvestile o sistemima bikulture koji uključuju indukovane pluripotentne matične ćelije (iPSC) izvedene iz kardiomiocita i fibroblasta, isključujući funkcije endotelnih ćelija.
Da bi popravili ovaj jaz, vanredni profesor Ken Takahaši, profesor Keiji Naruse i dr Jun Liu, povezani sa Fakultetom za medicinu, stomatologiju i farmaceutske nauke na Univerzitetu Okajama u Japanu, objavili su studiju u časopisu Naučni izveštaji 8. avgusta 2024.
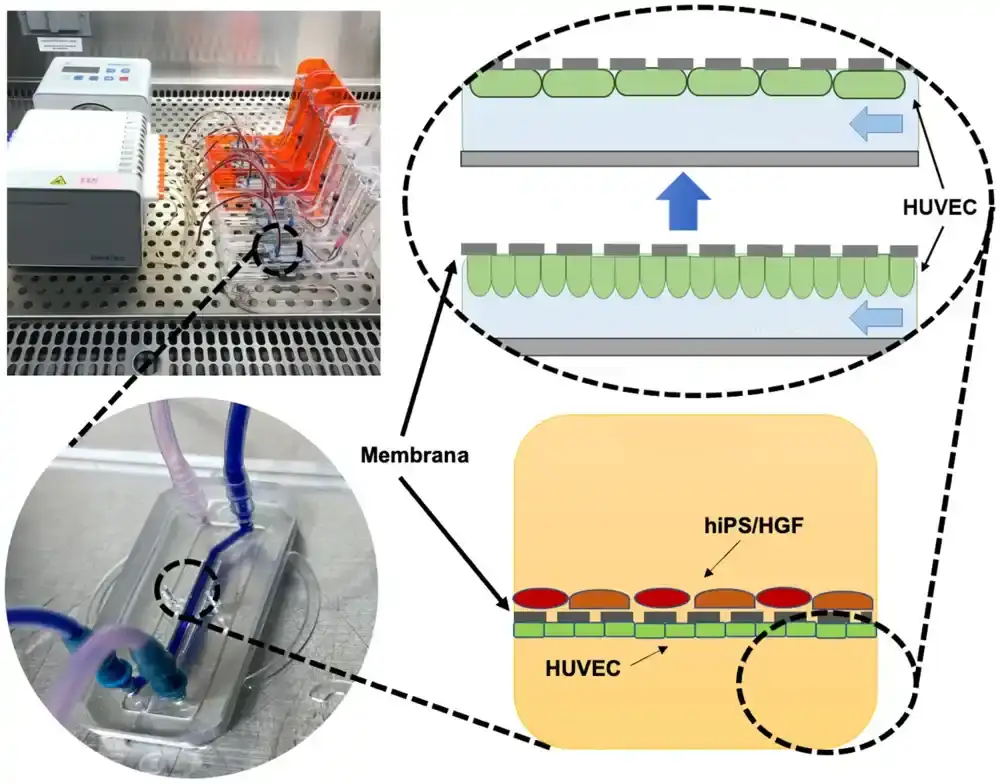
„U ovoj studiji smo razvili 3D model srce na čipu koristeći iPSC, fibroblaste i endotelne ćelije, dizajnirane da oponašaju anatomsku strukturu srčanog tkiva“, kaže dr Takahaši.
Model srce na čipu je dizajniran tako da uključuje dva kanala odvojena centralnom membranom. Endotelne ćelije umbilikalne vene (HUVEC) su zasejane u donji kanal i iPSC, a humani gingivalni fibroblasti (HGF) su zasejani u gornji kanal. Mikrofluidni kanali su imitirali intracelularni protok krvi.
Studija je uspešno replicirala morfologiju i funkcionalnost endotelnih ćelija. Kao odgovor na simulaciju smičnog stresa, endotelne ćelije su se postavile paralelno sa protokom medijuma tako što su na odgovarajući način orijentisale F-aktin, imitirajući na taj način in vivo uslove.
CD31, protein spoja ćelija-ćelija, igra ključnu ulogu u regulisanju vaskularne permeabilnosti. Povećana vaskularna permeabilnost može dovesti do disfunkcije endotela i doprineti progresiji ateroskleroze. Ova studija je pokazala da srednji protok unapređuje integritet endotelnih ćelija, što je potvrđeno bojenjem CD31 i nižom vaskularnom permeabilnosti.
Pored toga, prisustvo srčanog troponina t (cTnT) i IRKS4 (markeri kardiomiocita) ukazuje na visoku kontraktilnost.
„Procenat ćelija koje ko-eksprimiraju cTnT i IRKS4 bio je značajno povišen u grupi sa tri kulture (56,3 ± 14,7%, n = 5) za razliku od grupe sa bikulturama (30,2 ± 13,5%, n = P < 0,05),“ primećuje dr Takahaši.
Ova studija je pokazala funkcionalnost ljudskog srčanog tkiva repliciranjem efekata noradrenalina (NA) na kardiomiocite.
„Srčano tkivo je pokazalo povećanje srčane frekvencije zavisno od doze kao odgovor na NA“, primećuje dr Takahaši. Pored toga, primena nifedipina, dihidropiridin blokatora kalcijumovih kanala, smanjila je kontraktilnost srca i produžila KT interval, što ukazuje na potencijalnu kardiotoksičnost.
Dalja istraživanja bi trebalo da se fokusiraju na uključivanje inflamatornih odgovora sa imunim ćelijama kako bi se poboljšao model srca na čipu. Produženje održivosti modela organa preko 60 dana značajno će smanjiti troškove i postići važne istraživačke ciljeve.
Stvaranje modela organ-na-čipu koristeći pluripotentne ćelije izvedene od pacijenata transformiše personalizovanu medicinu obezbeđivanjem sigurnijih, efikasnijih lekova i eliminisanjem potrebe za testiranjem na životinjama.
Ovaj napredak ne samo da čini istraživanje etičnijim, već i povećava našu sposobnost da proučavamo srčane funkcije, predviđamo odgovore na lekove i ubrzavamo razvoj inovativnih terapija.