Međunarodni istraživački tim otkrio je novi mehanizam ključan za proizvodnju ćelijskih proteina. Kada je ovaj mehanizam poremećen, nacrti koje koristi ćelija za proizvodnju proteina se netačno uređuju kroz proces koji se zove spajanje.
Studija, koju je vodio Univerzitet Gete u Frankfurtu, baca svetlo na to kako specifične mutacije mogu dovesti do retinitis pigmentosa bolesti. Važno je da ovi nalazi takođe mogu otvoriti vrata novim dijagnostičkim testovima i tretmanima za niz drugih bolesti, uključujući određene vrste raka, Parkinsonovu i Alchajmerovu bolest.
Rad je objavljen u časopisu Nauka.
Geni sadrže esencijalna uputstva za izgradnju života, usmeravajući ćelije koje aminokiseline da se sastave u kom redosledu da bi proizvele specifične proteine. Ljudski genom kodira za oko 20.000 takvih instrukcija.
„Ipak, naše ćelije mogu da proizvedu nekoliko stotina hiljada različitih proteina“, objašnjava prof. Ivan Đikić sa Instituta za biohemiju II Gete univerziteta u Frankfurtu.
Ova raznolikost je omogućena procesom poznatim kao „spajanje“. Kada ćelija zahteva protein, ona generiše kopiju relevantnih instrukcija u ćelijskom jezgru. Tokom spajanja, ovaj transkript se podvrgava modifikaciji: kompleks za uređivanje ćelija, spliceosom, uklanja određene segmente. Ishod varira u zavisnosti od toga koji su delovi isečeni, što rezultira različitim nacrtima za različite proteine.
Ovaj proces je ključan za život ćelije.
„Splajzozom se sastoji od više komponenti koje obezbeđuju proizvodnju funkcionalnih proteina koji kontrolišu ćelijski život“, objašnjava Đikić. „Ako je ovaj kompleks poremećen, to može dovesti do smrti zahvaćene ćelije. Iz tog razloga, inhibitori spliceosoma se smatraju potencijalnim lekovima protiv raka.“
Međutim, loša strana je to što potpuna blokada ove „uređivačke kancelarije“ utiče i na zdrave ćelije, što dovodi do značajnih neželjenih efekata bilo kog inhibitora spliceosoma koji je do sada razvijen.
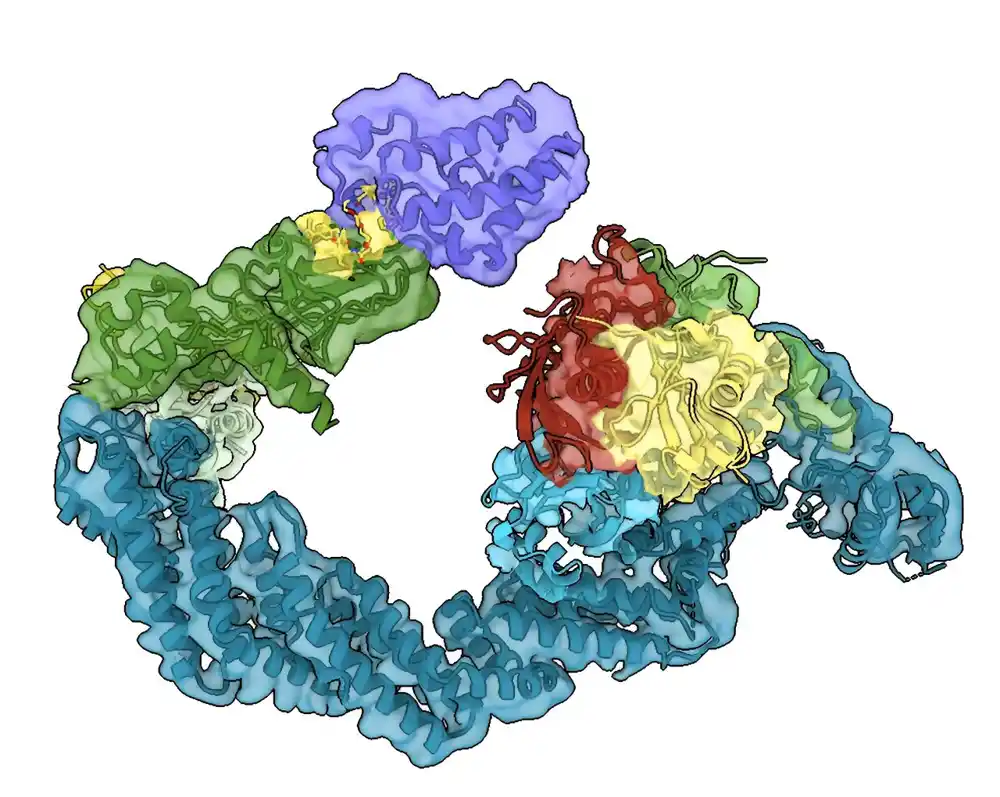
U međunarodnoj studiji koju je vodio Univerzitet Gete, istraživači su sada identifikovali mehanizam koji ometa proces spajanja na suptilniji način. Povezan je sa specifičnim delom spliceosoma, sastavljenom od tri podjedinice poznate kao U4/U6.U5.
„Već smo znali da su određene mutacije u ovim podjedinicama povezane sa očnom bolešću retinitis pigmentosa“, kaže dr Kristijan Prieto-Garsija sa Instituta za biohemiju II, prvi autor studije. „Ono što još nismo razumeli je tačan uticaj ovih mutacija.“
U eksperimentima sa zebricom, tim je sada uspeo da popuni ovu prazninu u znanju. Njihovi nalazi otkrivaju da su podjedinice spliceosoma U4, U5 i U6 normalno stabilizovane kao kompleks proteinom zvanim USP39. Međutim, kada su podjedinice mutirane ili je USP39 odsutan, stabilnost tripartitnog kompleksa je ugrožena, što dovodi do gubitka preciznosti spliceosoma. Tokom spajanja, U4/U6.U5 normalno obezbeđuje trenutno i ispravno ponovno spajanje labavih krajeva nakon što je transkript isečen. Bez USP39, ili kada su podjedinice mutirane, ovo ponovno spajanje je odloženo.
„Ovo povećava verovatnoću netačnih veza, kao što smo mogli da pokažemo u kompjuterskim simulacijama“, objašnjava Prieto-Garcia.
To rezultira pogrešno uređenim transkriptima, na osnovu kojih ćelija onda proizvodi disfunkcionalne proteine. Oni se akumuliraju i mogu formirati agregate unutar ćelije. Ćelije imaju sistem za odlaganje otpada za uklanjanje defektnih molekula, a ovaj zaštitni mehanizam se aktivira u ćelijama kojima nedostaje USP39. Vremenom, međutim, ovo „odlaganje smeća“ postaje preplavljeno proteinskim agregatima, što dovodi do smrti ćelija u retini zebrice.
„Otkriće ovog mehanizma bilo je neočekivano“, naglašava prof. Đikić. „Sumnjamo da to takođe može da objasni zašto ćelije mrežnjače kod pacijenata sa pigmentozom retinitisa umiru. Defektne varijante spajanja takođe mogu igrati ulogu u razvoju neurodegenerativnih bolesti poput Alchajmerove ili Parkinsonove. S druge strane, ovaj mehanizam može biti meta novih terapijskih pristupa za vrste raka koje u velikoj meri zavise od ispravne funkcije spliceosoma.“
Neki visoko agresivni tumori proizvode velike količine USP39 i srodnih faktora spajanja, verovatno zbog njihove visoke stope podele. Da bi održali konstantnu proizvodnju proteina, zahtevaju visoko precizno spajanje, funkciju koju pruža USP39.
„Blokiranje USP39 u ovim ćelijama raka moglo bi ih selektivno ubiti“, objašnjava Đikić. „Zdrave ćelije, sa druge strane, sa mnogo nižom aktivnošću deobe, bile bi pošteđene. Ovo je pristup koji trenutno istražujemo.“