Istraživači mogu da konstruišu ćelije da eksprimiraju nove gene i proizvode specifične proteine, dajući ćelijama nove delove za rad. Ali, mnogo je teže dati ćelijama uputstva o tome kako da organizuju i koriste te nove delove. Sada, novi alati istraživača Univerziteta Viskonsin-Medison nude inovativan način za rešavanje ovog problema.
Njihovo istraživanje objavljeno je u časopisu Cell.
Sve što ćelija radi zavisi od toga kako su molekuli organizovani unutar ćelije. Unutar naših ćelija — svih ćelija — proteini i drugi molekuli prolaze kroz organizaciju i reorganizaciju da bi izvršili ćelijsku funkciju. Poput flote prigradskih vozova koji se kreću u određenim intervalima duž svojih različitih ruta, proteini unutar ćelije su organizovani u vremenu i prostoru da obavljaju složene, ali predvidljive funkcije.
Dok je potreba za organizovanjem molekula unutar ćelije univerzalna među živim organizmima, specifični proteini i mehanizmi odgovorni za ovu organizaciju variraju. U sistemu specifičnom za bakterijske ćelije, na primer, proteini MinD i MinE – poznati zajedno kao MinDE – međusobno deluju duž ćelijske membrane da bi proizveli talasaste obrasce, koji pomažu u kretanju molekula unutar ćelije.
Kada molekuli ne uspeju da se pravilno organizuju u ćeliji, to može imati ozbiljne posledice, uključujući ćelije koje se neravnomerno dele i nepravilnu komunikaciju unutar i između ćelija, a oba su povezana sa razvojnim poremećajima i bolestima kao što je rak.
Ukratko, znamo kako da ćelijama damo neke nove delove, ali je mnogo teže dati uputstva kako da ih organizujemo i koristimo.
Mehanizmi pomoću kojih se molekuli organizuju i međusobno deluju međusobno su fino podešeni tokom milenijuma evolucije. Kada naučnici konstruišu ćelije da proizvode nove molekule, teško je naterati ćelije da koriste te nove molekule, a da se nenamerno ne poremete druge prirodne ćelijske funkcije.
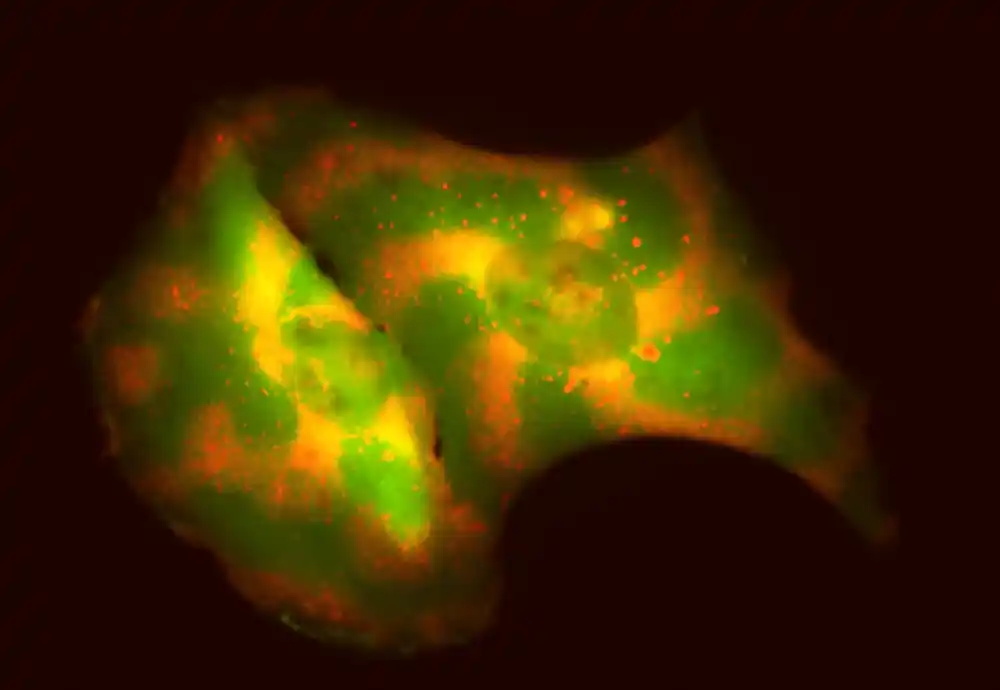
Biohemičari u UV-Madisonu razvili su alat za kontrolu kretanja i organizacije specifičnih proteina u ćelijama sisara, dok su ostali proteini ostali sami. Njihov novi alat koristi talase i oscilacije koje potiču od interakcija između MinDE proteina, koji se nalaze samo u bakterijama i ne ometaju ćelijsku funkciju sisara.
Inženjerskim interakcijama između MinDE proteina i proteina od interesa, istraživači su kreirali visoko specificirane obrasce za organizovanje molekula unutar ćelija sisara i izazivanje ćelijskog ponašanja i funkcija. Alat omogućava istraživačima da podešavaju i menjaju obrasce kao odgovor na stimulanse, u suštini programirajući molekule da se kreću po ćeliji do određenih lokacija tokom vremena.
Ovaj inovativni alat ima višestruku potencijalnu upotrebu za naučnike zainteresovane za projektovanje specifičnih ćelijskih aktivnosti ili proučavanje ćelijske aktivnosti u živom organizmu.
Kontrolisanje odnosa MinDE proteina omogućava istraživačima da dizajniraju obrasce kretanja koji određuju kako su molekuli organizovani u ćeliji, što bi se moglo koristiti za orkestriranje ćelijskih aktivnosti kao što je kretanje ili komunikacija sa drugim ćelijama.
Varijacije u obrascima kretanja se takođe mogu koristiti za proučavanje ćelijske aktivnosti. Pošto svaki odnos MinDE proteina emituje jedinstveni oscilatorni obrazac, proteini se mogu umetnuti u grupu ćelija da bi svakoj ćeliji dali sopstveni obrazac – individualni svetionik koji omogućava istraživačima da lakše posmatraju svaku ćeliju.
Naučnici takođe mogu da koriste jedinstvene obrasce za analizu signalnih obrazaca ćelije kako bi saznali o obliku, lokaciji i signalnoj aktivnosti svake pojedinačne ćelije. Istraživači iz UV–Madisonove Coile Lab-e ovu upotrebu alata upoređuju sa FM radio biranjem jer im omogućava da se podese na jedinstvene podatke koje svaka ćelija emituje u višećelijskom sistemu, što je zadatak koji je obično veoma težak.
Laboratorija Coile planira da nastavi da istražuje aplikacije alata, uključujući proučavanje dinamike signalnih puteva u tumorima, što je jedan klasičan primer ćelijskog ponašanja i funkcija koje su pošle naopako.