Istraživači koji ispituju sledeće granice u terapiji raka okrenuli su se bakterijama s obzirom na njihovu sposobnost da inhibiraju proliferaciju tumora kolonizacijom tumora. Ono što je najvažnije, Ahilova peta ovog pristupa je suboptimalna efikasnost lečenja uzrokovana inflamatornim odgovorom izazvanim bakterijama.
Zabrinutost je usledila signalna kaskada koja podstiče povećanje regulacije ciklooksigenaze II (COKS-2) u mikrookruženju tumora. COKS-2 promoviše anti-apoptotičku ekspresiju gena u tumorskim ćelijama i otpornost na hemoterapiju i imunoterapiju.
Da bi prevazišli ovo ograničenje, istraživači istražuju kako projektovane bakterije mogu optimizovati proces kolonizacije tumora i ciljanu isporuku lekova uz maksimalnu biološku bezbednost. Salmonela projektovana da cilja tumore dala je pozitivne rezultate u laboratoriji, ali je bila veoma toksična i proizvela nedovoljno terapeutske efekte u kliničkim ispitivanjima.
Idući napred, razvoj koji se teži poboljšanju efikasnosti ovih bakterijskih vektora uključuje modifikacije površine, molekularne modifikacije i hemijsku inkapsulaciju.
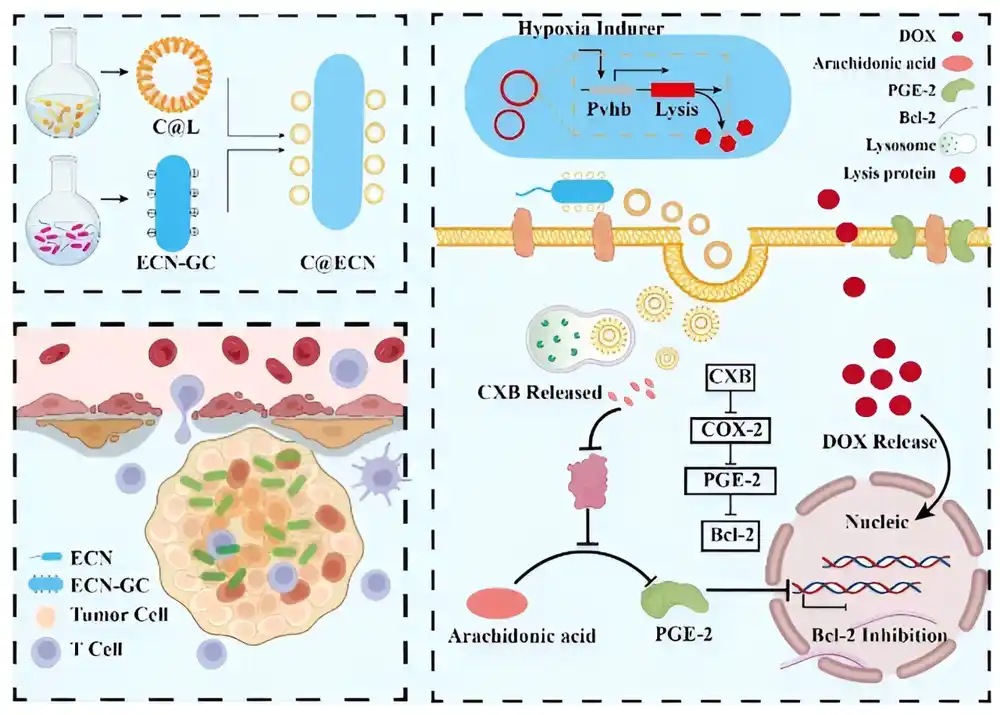
Nedavno je tim istraživača u Kini konstruisao soj Escherichia coli (E. coli) sa lipozomima za isporuku leka protiv raka i istražio njegovu sposobnost da kolonizuje mikrookruženje tumora. Tim je predvodio dr Jiaofang Huang iz Državne ključne laboratorije za bioreaktorsko inženjerstvo na Univerzitetu nauke i tehnologije Istočne Kine.
„Mikrookruženje tumora je hipoksično (nedostatak kiseonika) tako da je podložan kolonizaciji anaerobnih mikroba. Optimizacija ove kolonizacije za isporuku lekova protiv raka, i to bezbedno, daje veliko obećanje u onkologiji,“ kaže dr Huang. Studija je objavljena u BioDesign Research 25. juna 2024.
Da bi se prevazišla ograničenja svojstvena bakterijskim vektorima, tim je razvio soj E. coli (C@ECN-PL) kao platformu za isporuku lekova protiv raka. E. coli Nissle 1917 (ECN) je konstruisan pomoću kola za lizu izazvanu hipoksijom, eksprimovanog preko pGEKS-Pvhb-Lisis plazmida.
Ovaj krug samolize osigurao je da se isporuka leka u mikrookruženje tumora lišenog kiseonika može povezati sa minimalnom nenamernom proliferacijom bakterija. Anti-inflamatorni COKS-2 inhibitor celekoksib (CKSB) sekvestrira se u lipozome elektrostatički pričvršćene na površinu ECN ćelija (C@ECN).
Sistemi za isporuku lekova zasnovani na lipozomima su ranije bili testirani, ali je utvrđeno da ih ometa nisko korišćenje leka na meti. Ovo se desilo zbog retikuloendotelnog klirensa i nemogućnosti prodiranja u gustu ekstracelularnu matriksu tumora.
Vredi napomenuti da je CKSB toksičan, tako da je isporuka preko lipozoma pričvršćenih za bakterije obuzdala svaki neželjeni inflamatorni odgovor, osigurala ciljanu isporuku i minimizirala toksičnost.
Tim je želeo da shvati da li C@ECN-PL može povećati osetljivost tumorskih ćelija na lekove za hemoterapiju i testirao je efekat C@ECN-PL u kombinaciji sa doksorubicinom (DOKS) na tumorske ćelije.
„Kada smo testirali našu platformu za isporuku lekova C@ECN-PL u laboratoriji, otkrili smo da tačno isporučuje CKSB ćelijama tumora. Štaviše, naš projektovani bakterijski vektor je bio manje toksičan, minimizirao je štetne efekte CKSB-a i povećao dejstvo DOKS-a na tumor ćelije“, objašnjava dr Huang.
„Nakon naših eksperimenata na miševima, bili smo zadovoljni što smo otkrili da je C@ECN-PL kolonizirao mikrookruženje tumora i da je bezbedno eliminisan iz ovog regiona putem aktivacije kola samolize. Pored toga, izmerili smo snažnu inhibiciju COKS-2 od strane CKSB i povećana osetljivost tumorskih ćelija na DOKS tokom našeg istraživanja.“
Važan nalaz je bila sposobnost ECN-a da deluje kao imunološki adjuvans. Tim je otkrio da je preokrenuo supresiju izazvanu tumorom i uspešno regrutovao CD3+, CD4+ i CD8+ ćelije u mikrookruženje tumora.
Dr Huang je ohrabren potencijalom C@ECN-PL da revolucioniše isporuku lekova u onkologiji. „Suzbijanje inflamatornog odgovora protiv ECN-a i obezbeđivanje biokompatibilnosti ostaje ključno za njegov uspeh. Međutim, uveren sam da će budući razvoji učiniti ECN platformu robusnijom i omogućiti nam da isporučimo širok spektar lekova koji obuhvataju male molekule, RNK i proteine“, zaključuje on.