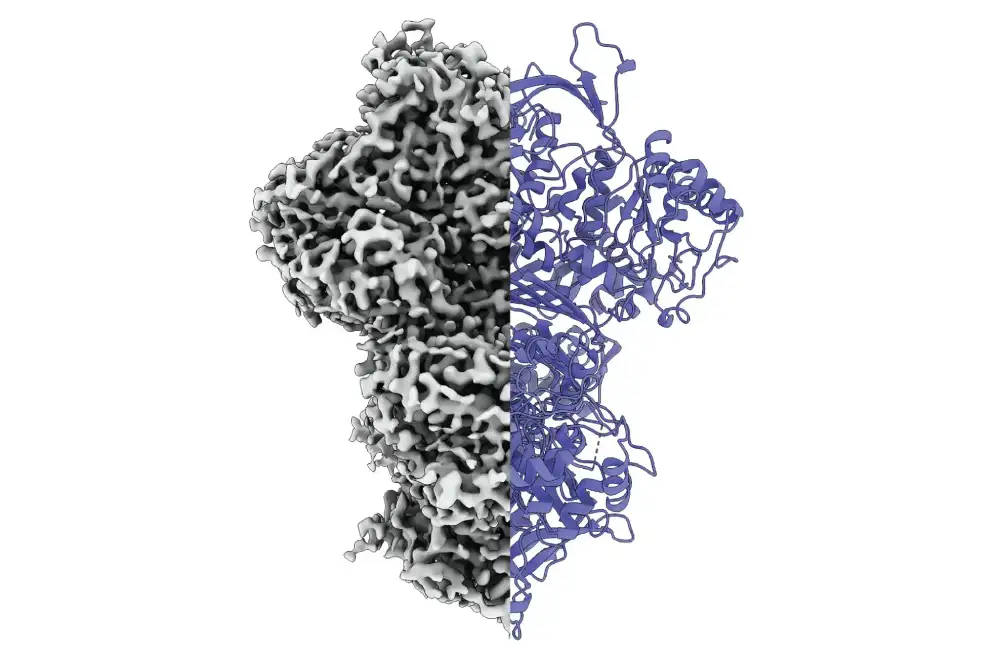
Protein „MIPS“ menja svoju unutrašnju strukturu kada postane aktivan. Njegov neuređeni aktivni centar postaje definisana struktura sa posebnim funkcijama. Protein igra ključnu ulogu u proizvodnji inozitola, koji je takođe poznat kao vitamin B8, i ispunjava važne zadatke u telu.
Istraživači sa Univerziteta Martin Luter Hale-Vitenberg (MLU) i Nacionalnog helenskog istraživačkog centra u Grčkoj uspeli su po prvi put da posmatraju protein kako se restrukturira. Kako tim izveštava u Zborniku radova Nacionalne akademije nauka, čini se da se ovaj proces javlja u mnogim sličnim proteinima.
Proteini kontrolišu sve vitalne procese u svakom organizmu, na primer rast i metabolizam. Osnovni princip istraživanja proteina je da struktura svakog proteina određuje njegovu funkciju. Ako je struktura oštećena samo u jednoj određenoj tački, protein više ne može da ispunjava svoju funkciju. U ljudskom telu to može dovesti, na primer, do ozbiljnih bolesti.
Međutim, postoje brojni proteini koji nemaju fiksnu strukturu, bilo u celini ili delimično. Ne samo da ih je teško analizirati, već se i njihova struktura menja u zavisnosti od okruženja.
„Proteini se često izoluju iz uzoraka pre nego što se analiziraju. Međutim, to nam ne omogućava da vidimo kako se ponašaju u svom prirodnom okruženju. Razvili smo metod koji nam omogućava da proučavamo proteine u skoro prirodnim uslovima“, objašnjava profesor Panagiotis Kastritis. , biohemičar na MLU.
Njegov tim je analizirao uzorke gljive Thermochaetoides thermophila, koja se koristi kao model organizma u istraživanjima. Rad je bio usredsređen na protein mio-inozitol-1-fosfat sintazu (MIPS), koji je od vitalnog značaja za proizvodnju inozitola. Supstanca je takođe poznata kao vitamin B8 i potrebna je za mnoge važne procese. Međutim, pošto ga telo proizvodi, ne smatra se pravim vitaminom.
„MIPS je deo dužeg metaboličkog puta koji vodi do proizvodnje inozitola“, objašnjava Toni Treger iz MLU. Već je istraživao protein kao deo svoje magistarske teze i sada je član Kastritisove istraživačke grupe.
Naučnici su koristili krio-elektronsku mikroskopiju da posmatraju protein na radu. Otkrili su da postoji u najmanje tri stanja: neuređeno stanje, uređeno stanje i vrsta trećeg međustanja.
„Do sada nismo definitivno shvatili zašto je potrebno ovo treće stanje. Možda pomaže u apsorpciji vode, što olakšava naknadne reakcije. Ili se možda dešava nešto sasvim drugo“, kaže Kastritis.
U daljem koraku, istraživači su istraživali da li proteini povezani sa MIPS-om pokazuju slično ponašanje. MIPS je deo posebne klase proteina poznatih kao izomeraze. Tim je analizirao podatke o strukturi više od 340 drugih izomeraza. I zaista, istraživači su pronašli jasne indikacije sličnog ponašanja.
Nalazi nisu od interesa samo za osnovna istraživanja. „Bolje poznavanje metaboličkih puteva i uključenih proteina može otvoriti nove terapijske pristupe. Naš rad predstavlja važan prvi korak“, zaključuje Kastritis.