Mnogi od nas se sećaju sa časa biologije u srednjoj školi da su mitohondrije „elektrane“ ćelije. Ove male strukture u obliku zrna pasulja su ono što pretvara hranljive materije iz hrane u ATP — „energetsku valutu“ ćelije. Ćelije troše tu valutu svaki put kada obavljaju osnovne ćelijske aktivnosti, bilo da je to kodiranje uspomena u nervnim ćelijama ili detoksikaciju hemikalija u ćelijama jetre.
Ova priča je istinita, ali je nepotpuna. Ćelijama je potrebno više od energije za život, potrebni su im i građevinski blokovi — sirovine od kojih se prave kopije svojih komponenti, tako da kada rastu i podele, svaka nova ćelija dobija pun i jednak udeo delova.
Dugi niz godina nije bilo jasno gde se u ćeliji prave ovi gradivni blokovi. Ali tokom protekle decenije, naučnici su naučili da mitohondrije takođe kontrolišu ovaj proces. Umesto da koriste hranljive materije za proizvodnju ATP-a, mitohondrije mogu da ih koriste da naprave ćelijske građevne blokove koji će formirati DNK, nove proteine i nove ćelijske membrane.
Kako mitohondrije biraju kojim od ova dva suprotna puta da idu?
„To je bilo pitanje na koje smo želeli da odgovorimo“, kaže Craig Thompson, MD, član Programa za biologiju i genetiku raka u Institutu Sloan Kettering u Memorijalnom centru za rak Sloan Kettering (MSK) i stariji autor novog objavljenog rada 6. novembra 2024. u Prirodi . „Kako mitohondrije balansiraju ove dve osnovne funkcije koje obavljaju za sve ćelije u našem telu?“
U tipičnim okolnostima, kaže on, ćelijama je lako da izjednače svoje bilanse. Kada su hranljive materije u izobilju – kada naše ćelije dobijaju sve hranljive materije koje su im potrebne, a zatim i neke – ćelije mogu da iskoriste te hranljive materije da obezbede adekvatnu zalihu ATP-a, kao i da naprave dovoljno ćelijskih gradivnih blokova za rast i deobu.
Ali šta se dešava u vreme stresa, kada su hranljive materije oskudne, a potražnja za ATP-om i ćelijskim gradivnim blokovima velika? Niko nije znao odgovor na to pitanje.
Da biste razumeli dilemu sa kojom se ćelija suočava, kaže dr Tompson, razmislite šta se dešava kada se posečete.
„Krv počinje da se izliva, a sa njom i hranljive materije koje normalno održavaju tkivo. Ćelije su sada u stresnoj situaciji. Hitno im je potreban ATP da potroše na proces zarastanja, a takođe su im hitno potrebne nove zalihe za popravku ranjenog tkiva. Kako ćelija odlučuje između ovih konkurentskih zahteva nije bilo jasno.“
U svom novom radu, dr Tompson i njegove kolege u izuzetnim detaljima pokazuju kako se mitohondrije suočavaju sa ovim uznemirujućim problemom. Kroz dramatičan i dinamičan proces fizičke i hemijske transformacije, mitohondrije formiraju različite subpopulacije koje su specijalizovane za zadovoljavanje svakog od konkurentskih zahteva.
Krajnji rezultat je skoro savršena podela rada, sa jednom subpopulacijom opremljenom mašinama za pravljenje ATP-a, i jednom subpopulacijom opremljenom mašinama za izgradnju novih ćelijskih struktura.
Nova otkrića ne samo da odgovaraju na fundamentalno pitanje o ćelijskoj biologiji, već imaju i direktne implikacije za razumevanje raka – oličenje stresnog biološkog događaja.
Dr Tompson i njegove kolege, predvođeni Keunvoo Riuom, doktorom nauka, postdoktorskim saradnikom u laboratoriji, započeli su pitanjem šta bi se desilo ako ćelije stave u stresnu situaciju, gde je, na primer, mala količina hranljiva glukoza i istovremeno velika potražnja za ATP. Možda sumnjate da će ćelije favorizovati stvaranje ATP-a na račun stvaranja blokova za izgradnju ćelija. To, međutim, nije ono što su istraživači otkrili.
„Povećana potražnja za ATP-om ni na koji način nije ugrozila sposobnost ćelija da prave druge molekule za rast“, kaže dr Tompson.
To je bio veoma čudan nalaz, koji je izgledalo kao da „krši zakone termodinamike“, dodaje on.
Bilo bi kao da je pekar počeo sa sastojcima da napravi jednu pitu od jabuka od 12 inča, ali je na kraju kuvanja imao dve pite od 12 inča. To je naučnicima govorilo da se dešava nešto veoma neobično.
Jedan nagoveštaj misterije o tome kako mitohondrije mogu da obavljaju dve funkcije odjednom došao je iz pogleda na to koje enzime dva različita puta imaju zajedničko. Našli su samo jedan: enzim nazvan P5CS.
„P5CS je vrsta proteina koji je neophodan da bi se donela odluka između ova dva puta“, objašnjava dr Tompson.
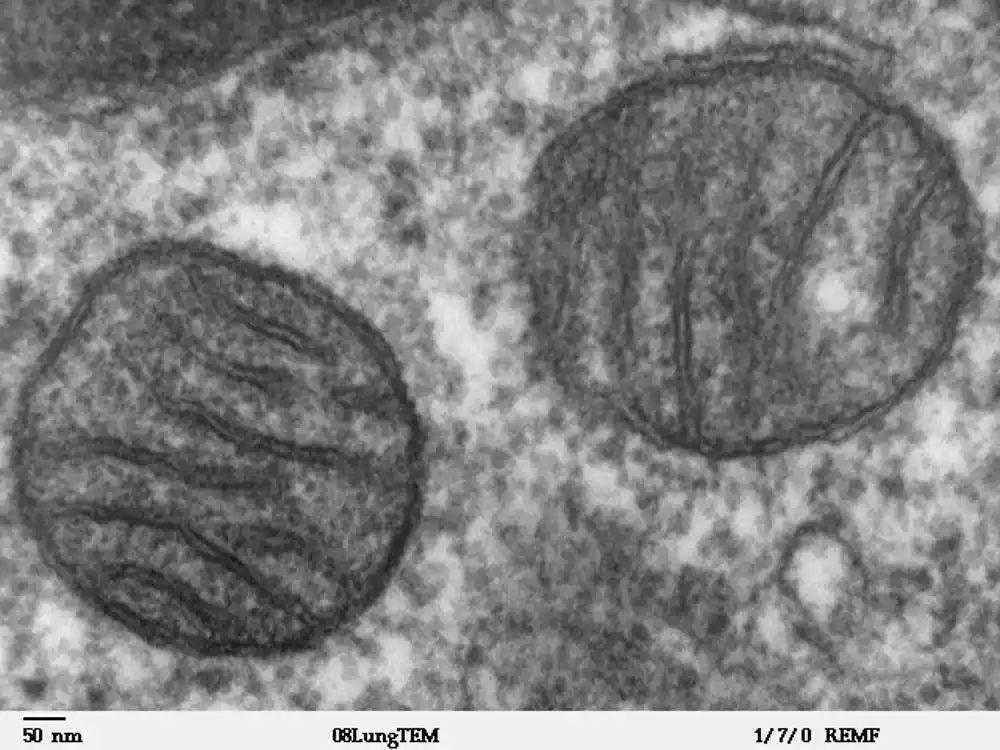
Kada je tim detaljnije pogledao šta P5CS radi u ćelijama pod stresom, videli su da su se pojedinačni P5CS enzimi udružili da bi napravili dugačke filamente. Ali začudo, filamenti su formirani samo u jednoj subpopulaciji mitohondrija; u drugom su bili odsutni.
Subpopulacija mitohondrija sa filamentima P5CS bila je primetno drugačija na druge načine. Tipično, u mitohondrijama koje mogu da proizvode ATP, unutrašnja membrana mitohondrija formira zamršene presavijene strukture zvane kriste, koje su često vidljive u mitohondrijama prikazanim u udžbenicima. Ali u mitohondrijama bogatim P5CS, kriste su bile odsutne.
Nakon daljeg ispitivanja, postalo je jasno da su dve subpopulacije potpuno razdvojile svoje uloge, pri čemu je jedna populacija postala modernizovana samo za pravljenje ATP-a, a jedna populacija postala specijalizovana za pravljenje novih ćelijskih gradivnih blokova.
Suštinski rezultat ove podele rada je da je svaka subpopulacija postala bolja u obavljanju svog posla, što pomaže da se objasni zašto su te prvobitne ćelije pod stresom bile u stanju da naprave i dovoljno ATP-a i dovoljno gradivnih blokova da prežive i rastu u stresnim uslovima.
Ali kako uopšte nastaju dve različite podpopulacije? Evo gde priča postaje još fascinantnija. Naučnici su decenijama znali da su mitohondrije veoma dinamične organele. Oni prolaze kroz događaje fuzije i fisije, u kojima se pojedinačni mitohondriji spajaju, a zatim se razdvajaju, iznova i iznova.
Naučnici su pretpostavili da su događaji fuzije i fisije neophodni da bi se reciklirale komponente mitohondrija oštećene u veoma zahtevnom procesu stvaranja ATP-a. To je možda istina. Ali ova nova studija pokazuje da je proces fuzije i fisije takođe neophodan da bi se filamenti P5CS odvojili u jednu subpopulaciju i mašine za pravljenje ATP-a u drugu.
„To je bilo iznenađenje“, kaže dr Tompson. „Verujem da je ovo prvi put da je neko pokazao da su mitohondrijalna fuzija i fisija neophodne da bi se funkcije mitohondrija odvojile u subpopulacije.“
Zašto je ovo relevantno za rak? Pa, kao što svako ko radi na terenu zna, ćelije raka su sposobne da prežive u stresnim uslovima koji obično ubijaju normalne ćelije. Na primer, ćelije raka mogu da prežive u samom centru tumora gde su hranljivi sastojci i kiseonik oskudni. Nijedna obična ćelija to ne može.
Da bi videli da li se mitohondrijalne promene dešavaju u kontekstu raka, dr Tompson i njegove kolege su pogledali uzorke tkiva raka pankreasa, jednog od najagresivnijih karcinoma. Naravno, tumori su razvili diskretne subpopulacije mitohondrija, dok okolno normalno tkivo nije.
„Čini se da ove mitohondrijalne promene pokreću progresiju raka, barem kod duktalnog adenokarcinoma pankreasa“, kaže dr Tompson. Njegov tim sada traži da li ovo otkriće važi i za druge vrste raka.
Oni takođe žele da istraže kako ove mitohondrijalne promene mogu biti u osnovi progresije raka. „Može biti da one podstiču kako ćelije raka stiču sposobnost da metastaziraju ili se šire“, kaže on.
Postoji čak moguća veza sa starenjem. „Smatramo da će razumevanje ove mitohondrijalne dinamike biti kritično za naše razumevanje kako možemo olakšati popravku tkiva i regeneraciju tkiva kako starimo“, kaže dr Tompson. „Kada vidimo ove mitohondrijalne promene, da li je to znak da je tkivo pod stresom? Mi takođe istražujemo tu ideju.“