Istraživači sa Univerziteta Tokio Metropolitan kreirali su novi molekul za isporuku lekova, cviterjonski polimerni kompleks koji može pomoći da se plazmidna DNK unese u ćelije kada se ubrizga u skeletne mišiće, što je ključni korak u ekspresiji terapeutske RNK i proteina. Studija je objavljena u časopisu Biomaterials Science.
Novo jedinjenje je efikasno vezano za plazmidnu DNK bez uticaja na njegovu strukturu. Ubrizgan u mišiće miša, tim je primetio široko rasprostranjenu ekspresiju gena.
Sistemi isporuke lekova su u osnovi mnogih kliničkih otkrića našeg doba. Na primer, vakcina protiv COVID-19 koristi lipidne nanočestice da obuhvati mesindžer RNK (mRNK) i prenese ih u ćelije procesom koji se zove endocitoza; jednom unutra, mRNK se oslobađa putem „endosomskog bekstva“ pre nego što je ćelijske mašinerije „prevedu“ u antigene koji izazivaju imuni odgovor.
Ali iako su takve metode uspešno korišćene, još uvek postoje izazovi koje treba prevazići, kao što je neželjeno agregiranje nosioca. Kako se tretmani diverzifikuju, istraživači su u potrazi za novim metodama isporuke za širi spektar primena.
Tim sa Univerziteta Metropoliten u Tokiju, predvođen profesorom Shoichiro Asaiamaom, proučavao je upotrebu polijona, polimera sa električnim nabojem, za prenos plazmidne DNK (pDNK) u ćelije.
Plazmidna DNK se može transkribovati u RNK za glasnike ili prevesti u proteine, što ih čini raznovrsnim nosačem za terapije. Takođe se dešava da su negativno naelektrisani polimeri koji se mogu vezati za pozitivno naelektrisane polijone.
Međutim, jednostavno pravljenje velikog, pozitivno naelektrisanog polimera je daleko od idealnog, jer bi njihov naboj mogao da ih učini toksičnim za ćelije. Nedavni napori su se okrenuli ka cviterionima, odnosno jedinjenjima sa pozitivnim naelektrisanjem na jednom delu i negativnim naelektrisanjem na drugom.
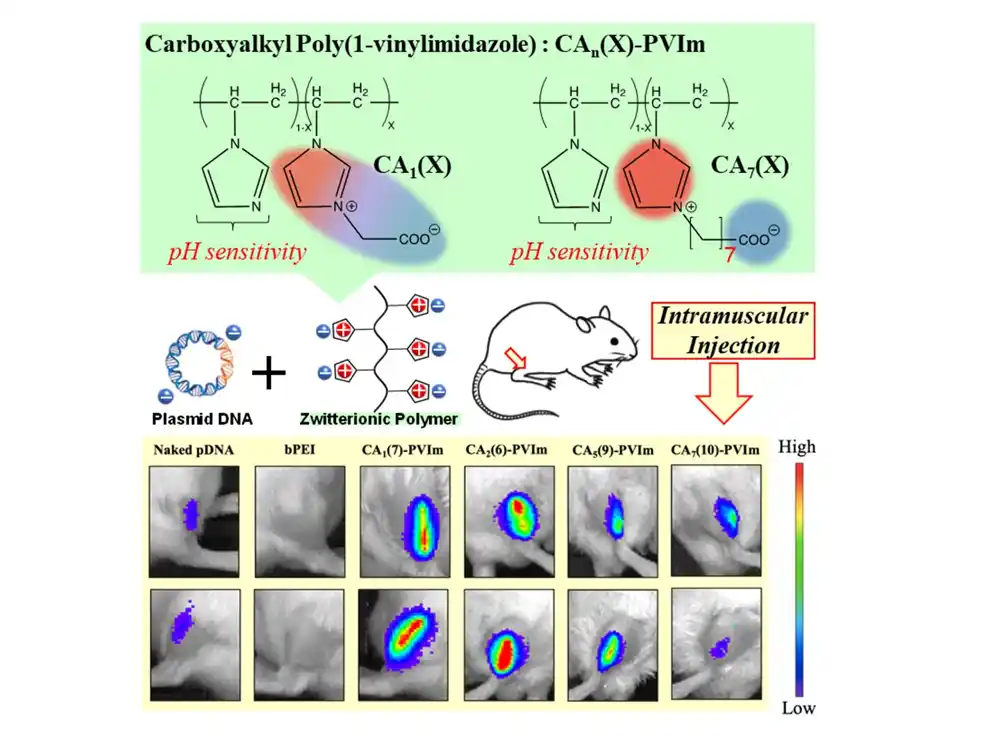
Sada je tim konstruisao prvo cviterjonsko polimerno jedinjenje (CA-PVIm) sa katjonom imidazolijuma (pozitivno naelektrisanje) koje može da kompleksira sa pDNK.
Imidazolijum grupe imaju prednost u tome što imaju pozitivan naboj razmazan preko prstena atoma, što im daje dobre šanse da se snažno vežu za pDNK. Negativno naelektrisani delovi su bili sastavljeni od karboksilnih grupa raspoređenih kratkim ugljovodoničnim lancem; oni su dodavani u polimerni lanac u različitim proporcijama.
U preliminarnim eksperimentima, otkrili su da njihovo novo jedinjenje ima sloj vezanih molekula vode u rastvoru koji bi ih mogao učiniti bioinertnim. Pomešan sa pDNK, korišćen je metod za razdvajanje jedinjenja DNK po dužini da bi se pokazalo da pDNK može uspešno da se kompleksira sa CA-PVIm. Druga merenja su takođe pokazala da je složena hijerarhijska struktura pDNK očuvana.
Tim je stavio svoje jedinjenje na test ubrizgavanjem u mišićno tkivo miševa. U poređenju sa golom pDNK, pronašli su ekspresiju gena zbog pDNK na drastično širem području.
Ovo je jasno pokazalo da se njihov poliion preuzima u ćelije i podvrgava endosomskom bekstvu. Takođe su identifikovali optimalno jedinjenje, sa 7% dostupnih mesta sa negativnim nabojem (CA(7)-PVIm), koje je dalo najveći efekat.
Pošto može da isporuči svoj teret preko velikih masa mišića, nalazi tima obećavaju nove terapije za ozbiljne mišićne bolesti.