Istraživači predvođeni Elizabeth McNalli, MD, Ph.D., Elizabeth J. Vard profesorom genetske medicine i direktorom Centra za genetsku medicinu, otkrili su ranije nepoznate interakcije proteina u pretkomoru srca koje su ključne za normalnu funkciju srca, prema na nalaze objavljene u Proceedings of the National Academi of Sciences .
Srce je podeljeno na četiri komore: dve na vrhu (atrijum/pretkomore) i dve na dnu (ventrikule), sa po jednom sa svake strane srca. Sposobnost srčanih ventrikula da pumpa krv siromašnu kiseonikom u pluća i krv bogatu kiseonikom u ostatak tela zavisi od pretkomora, koji dosledno ponovo pune komore krvlju.
Atrijumi su takođe glavno mesto za bolest, posebno atrijalnu fibrilaciju, koja se javlja kada se atrijumi više ne kontrahuju normalno i umesto toga imaju brze, nekoordinisane i nepravilne otkucaje srca ili aritmiju. Ovo haotično otkucaje narušava normalno punjenje komora i može na kraju dovesti do moždanog udara, pa čak i srčane insuficijencije.
„Konačno počinjemo da imamo dobre alate za gledanje atrijuma kako bismo prepoznali svojstva relaksacije kao važna i neophodna za funkciju srca u celini. Ako pretkomora ne može da radi svoj puni posao, onda komore ne mogu da rade njihov pun posao“, rekao je Mekneli, koji je takođe profesor medicine na Odeljenju za kardiologiju i biohemiju i molekularnu genetiku.
Međutim, precizni mehanizmi koji regulišu atrijalnu kontrakciju i relaksaciju nedavno su privukli više pažnje otkrićem novih proteina koji ranije nisu bili cenjeni, kaže McNalli.
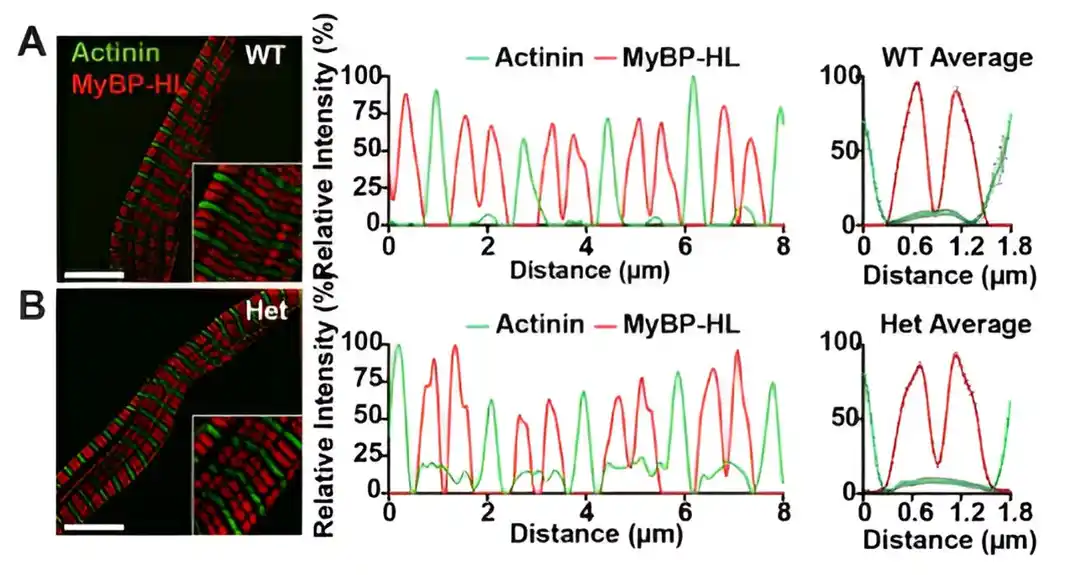
U prethodnoj studiji iz McNalli laboratorije objavljenoj u Circulation, istraživači su otkrili gen MIPBHL i da mutacije u ovom genu povećavaju rizik od aritmije i kardiomiopatije. MIBPHL je gen koji kodira H-sličan protein koji vezuje miozin (MiBP-HL), koji je deo kontraktilne mašinerije koja se nalazi uglavnom u pretkomora.
Pored toga, MiBP-HL pripada istoj porodici proteina kao i protein-C koji vezuje miozin (cMiBP-C), koji deluje kao sistem kočenja za srce kako bi sprečio njegovo prekomerno kontrakciju. Mutacije u genu koji kodira cMiBP-C su važan uzrok hipertrofične kardiomiopatije. Međutim, odnos između ova dva proteina i njihov kombinovani uticaj na funkciju komore i atrija je ostao slabo shvaćen.
U trenutnoj studiji, koristeći mikroskopiju strukturiranog osvetljenja, imuno-elektronsku mikroskopiju i masenu spektrometriju za analizu srčanih ćelija sa genetskih modela miša, tim je identifikovao novu vezu između MiBP-HL i cMiBP-C.
Konkretno, gubitak MiBP-HL udvostručio je količinu cMiBP-C u atrijuma, dok je gubitak cMiBP-C udvostručio količinu MiBP-HL u pretkomora. Gubitak MiBP-HL takođe je ubrzao atrijalnu relaksaciju.
Sve u svemu, nalazi ističu novi mehanizam i suštinsku ulogu za MiBP-HL u regulisanju atrijalne relaksacije i funkcije.
Nalazi mogu takođe rasvetliti abnormalna svojstva atrijalne relaksacije koja se vide kod srčane insuficijencije i u srcu kako stari, kaže McNalli. Srce, posebno atrija, postaje tvrđe sa godinama, a MiBP-HL takođe može biti biomarker za atrijalne abnormalnosti, kao što je atrijalna fibrilacija, prema autorima.
„Naš rad na MIBPHL-u izazvao je interesovanje za načine na koje se kontrakcija pretkomora razlikuje od ventrikula. Ovi nalazi su uzbudljivi jer sada imamo novi potencijalni terapeutski cilj za modulaciju atrijalne kontraktilne funkcije“, rekao je Dave Barefield, dr. bivši postdoktorski saradnik u McNalli laboratoriji i prvi autor studije.