Lečenje raka već dugo ide ka personalizaciji — pronalaženju pravih lekova koji deluju na jedinstveni tumor pacijenta, na osnovu specifičnih genetskih i molekularnih obrazaca. Mnoge od ovih ciljanih terapija su veoma efikasne, ali nisu dostupne za sve vrste raka, uključujući karcinom pluća ne-malih ćelija (NSCLC) koji imaju genetsku mutaciju LKB1.
Nova studija koju su vodili profesor Instituta Salk Ruben Šo i bivša postdoktorska koleginica Lilijan Ajhner, sada docent na Univerzitetu Northvestern, otkrila je da se trametinib i entinostat koji je odobrila FDA (koji je trenutno u kliničkim ispitivanjima) mogu davati u tandemu kako bi se proizvodilo manje i manje. tumori kod miševa sa NSCLC mutiranim u LKB1.
Nalazi su objavljeni u časopisu Science Advances 17. marta 2023.
„Za slučajeve karcinoma pluća ne-malih ćelija sa mutacijom LKB1, standardni tretmani hemoterapije i imunoterapije nisu efikasni“, kaže Šo, stariji i ko-korespondentni autor studije i direktor Salkovog centra za rak. „Naši nalazi pokazuju da postoji način da se ciljaju ovi slučajevi koristeći lekove koji su odobreni od strane FDA ili su već u kliničkim ispitivanjima, tako da bi se ovaj rad lako mogao koristiti za kliničko ispitivanje na ljudima.“
Otprilike 20 procenata svih NSCLC ima genetsku mutaciju LKB1, što znači da trenutno na tržištu ne postoje efikasne ciljane terapije za pacijente sa ovim tipom raka. Da bi stvorili terapiju koja bi mogla da cilja mutaciju LKB1, istraživači su se okrenuli histon deacetilazama (HDAC). HDACs su proteini povezani sa rastom tumora i metastazama raka, sa karakterističnom prekomernom ekspresijom u solidnim tumorima.
Nekoliko HDAC-inhibitornih lekova je već odobrila FDA (bezbedna za ljudsku upotrebu) za specifične oblike limfoma, ali nedostaju podaci o njihovoj efikasnosti u solidnim tumorima ili da li tumori koji nose specifične genetske promene mogu da ispolje povećan terapeutski potencijal.
Na osnovu prethodnih nalaza koji povezuju gen LKB1 sa tri druga HDAC-a koji se svi oslanjaju na HDAC3, tim je započeo sprovođenjem genetske analize HDAC3 u mišjim modelima NSCLC, otkrivajući neočekivano kritičnu ulogu HDAC3 u više modela. Nakon što su utvrdili da je HDAC3 kritičan za rast tumora koji se teško leče LKB1-mutantima, istraživači su zatim ispitali da li farmakološko blokiranje HDAC3 može dati sličan moćan efekat.
Tim je bio radoznao oko testiranja dva leka, entinostata (inhibitor HDAC u kliničkim ispitivanjima za koji se zna da cilja na HDAC1 i HDAC3) i trametinib koji je odobrila FDA (inhibitor za drugu klasu enzima povezanih sa rakom). Tumori često postaju brzo otporni na trametinib, ali istovremeni tretman sa lekom koji inhibira protein nizvodno od HDAC3 pomaže u smanjenju ove rezistencije.
Pošto se taj protein oslanja na HDAC3, istraživači su verovali da bi lek koji cilja HDAC3 – poput entinostata – takođe pomogao u upravljanju otpornošću na trametinib.
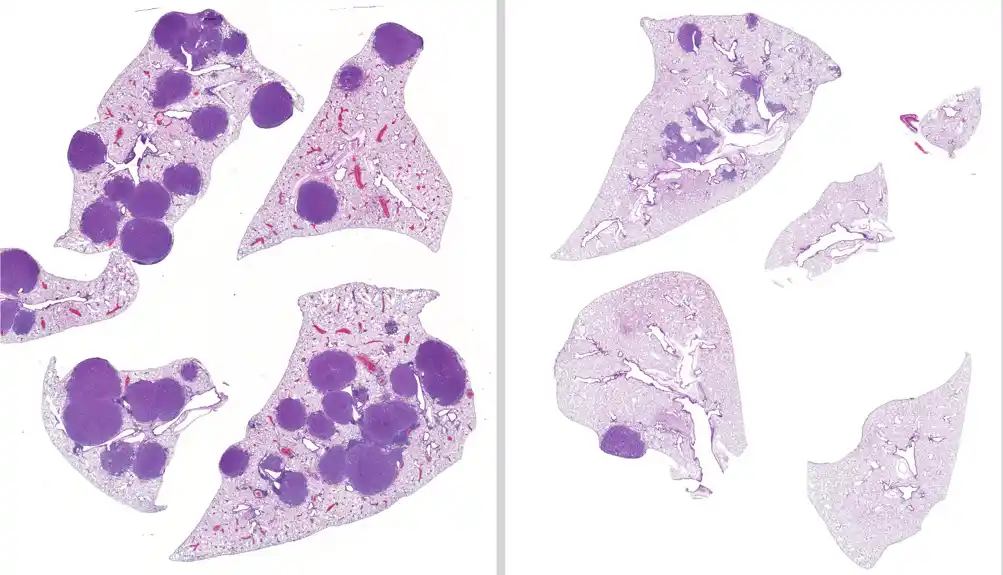
Nakon lečenja miševa sa LKB1 mutiranim rakom pluća sa promenljivim režimima lečenja tokom 42 dana, tim je otkrio da su miševi kojima su davani i entinostat i trametinib imali 79 procenata manji volumen tumora i 63 procenta manje tumora u plućima nego nelečeni miševi. Pored toga, tim je potvrdio da je entinostat održiva opcija lečenja u slučajevima kada je tumor otporan na trametinib.
„Mislili smo da je cela klasa enzima HDAC direktno povezana sa uzrokom mutantnog karcinoma pluća LKB1. Ali nismo znali specifičnu ulogu HDAC3 u rastu tumora pluća“, kaže prvi i korespondentni autor Eichner. „Sada smo pokazali da je HDAC3 neophodan u karcinomu pluća i da je ranjivost terapijske rezistencije koja se može promeniti.
Nalazi mogu dovesti do kliničkih ispitivanja za testiranje novog režima na ljudima, pošto je entinostat već u kliničkim ispitivanjima i trametinib je odobren od strane FDA. Važno je da Šo vidi ovo otkriće kao transformativno za kancere izvan NSCLC, sa potencijalnom primenom kod limfoma, melanoma i raka pankreasa.
„Naša laboratorija je godinama posvetila ovom projektu, čineći male i značajne korake ka ovim nalazima“, kaže Šo, nosilac katedre Villiam R. Brodi. „Ovo je zaista uspešna priča o tome kako osnovna otkrića nauke mogu dovesti do terapeutskih rešenja u ne tako dalekoj budućnosti.“
„Moja nezavisna laboratorija je srećna što je deo Lurie centra za rak na Medicinskom fakultetu Fajnberg na Univerzitetu Northvestern, koji veoma podržava translaciona istraživanja. Nadamo se da će ovo okruženje olakšati pokretanje kliničkog ispitivanja zasnovanog na ovim nalazima“, kaže Ajhner.