Naučnici sa Medicinske škole UMass Chan razvili su tehnologiju za isporuku genske terapije direktno u plućno tkivo putem intranazalne administracije, razvoj koji bi potencijalno mogao stvoriti novu klasu tretmana za plućne bolesti.
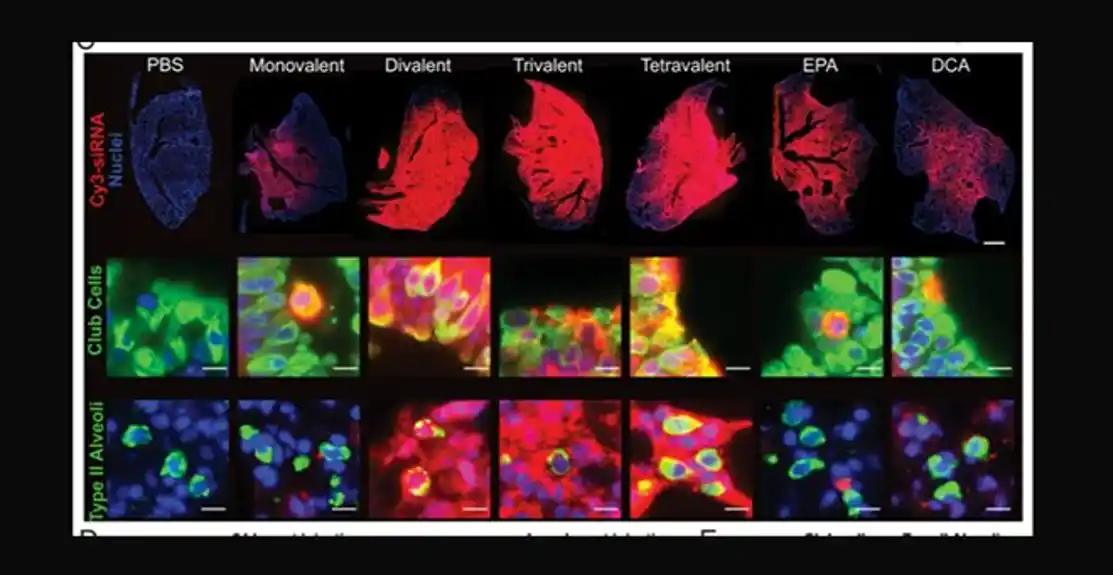
Objavljena u časopisu Proceedings of the National Academi of Sciences, studija multidisciplinarnog tima RNK biologa, hemijskih biologa, imunologa i virologa opisuje isporuku molekula siRNA lokalno u plućno tkivo. To je prva demonstracija da se multimerni molekuli siRNA mogu uneti u pluća nakon intranazalne primene i postići bezbedno i robusno genetsko utišavanje. Što je još važnije, tehnologija platforme je prilagodljiva za druge plućne bolesti kao što su plućna fibroza i respiratorni virusi.
„Postizanje snažnog utišavanja na ovom nivou koji se dobro toleriše nije postignuto ranije“, rekao je dr Vignesh N. Hariharan, koautor studije i postdoktorski saradnik u laboratoriji dr Anastasije Khvorove. ., porodična katedra Remondi za biomedicinska istraživanja i profesor RNK terapije. „Pokazali smo dovoljno utišavanja da bismo dokazali da se antivirusna efikasnost može postići sa siRNA i mislimo da je ova arhitektura put napred ka korišćenju utišavanja RNK u terapiji u plućima. Ovo bi potencijalno otvorilo novu klasu terapeutika za lečenje plućnih bolesti. “
Koristeći novu hemijsku skelu, dr Hariharan i kolege su uspešno isporučili stabilizovane dvovalentne siRNA molekule na životinjske modele koji su blokirali SARS-CoV-2 i sprečili infekciju.
„Pluća su težak organ za dopremanje RNK molekula jer su veoma osetljiva na potencijalne toksine i čestice koje mogu izazvati imunološke reakcije“, rekao je Hariharan.
Mala interferirajuća RNK (siRNA) je klasa kratkih, nekodirajućih RNK molekula, dužine samo 20 do 24 para baza, koji se nalaze u ćelijama i koji se mogu proizvesti sintetički. Oni su deo sistema RNA interferencije (RNAi) koji je prvi identifikovao dobitnik Nobelove nagrade za 2006. Craig Mello na UMass Chan Medical School.
Molekuli siRNA ometaju ekspresiju gena vezivanjem za RNK (mRNA) nakon što je transkribovana iz genoma. Jednom vezana za svoju metu, siRNA regrutuje ćelijske proteine koji presecaju iRNK, koju ćelija zatim prirodno razgrađuje pre nego što može da proizvede odgovarajući protein. Ovo sprečava ćeliju da pravi proteine iz te specifične genetske sekvence.
„Ako mislite o ćeliji kao o ogromnom bloku teksta u programu za obradu teksta, siRNA je poput funkcije pretraživanja i pronalaženja; koristeći pravu kombinaciju slova možete pronaći bilo koju reč u tekstu, ili u ovoj analogiji, bilo koju genetski niz“, rekao je dr Džonatan K. Vots, profesor RNK terapije i koautor studije. „Koristeći siRNA možemo da podrimo proces proizvodnje proteina brisanjem specifičnih sekvenci mRNA koje izazivaju bolest pre nego što se pretvore u protein, što nam omogućava da lečimo bolest.“
U mišjem modelu SARS-CoV-2, dr Vots i njegove kolege su uspeli da isporuče siRNA koja se vezuje za virusnu iRNK i degradira unutar ćelija. Sekvenca na koju su ciljali istraživači pronađena je u svim poznatim varijantama SARS-Cov-2 uključujući delta i omikron, što je navelo tim da veruje da je njegova funkcija kritična za opstanak virusa. Isporuka ove hemijski modifikovane siRNA na životinjske modele smanjila je translaciju proteina za 60 do 80 procenata, nivo dovoljno jak da spreči infekciju.
„Optimizacija hemijske skele je ključna za kliničku primenu siRNA terapeutika u plućnom tkivu“, rekao je Vatts. „Postoje i drugi mehanizmi isporuke, kao što su RNK obložene lipidima, koji dobro funkcionišu za tkiva kao što je jetra, ali ovaj pristup nije lako prilagoditi za pluća.“
Praveći molekul siRNA sa hemijski modifikovanim nukleotidima, Vatts i kolege mogu zaštititi siRNA od prebrze razgradnje od strane ćelija. Ovo zadržava siRNA duže u plućima i omogućava joj da prođe kroz imunološki odgovor.
Sledeći korak je da istraživači primene ovaj novi hemijski pristup za isporuku siRNA u pluća za druge plućne bolesti uključujući plućnu fibrozu i astmu.