Naučnici su otkrili da najrasprostranjenija klasa antimikotika na svetu izaziva samouništenje patogena. Istraživanje koje je vodio Univerzitet u Ekseteru moglo bi pomoći u poboljšanju načina zaštite sigurnosti hrane i ljudskih života.
Gljivične bolesti uzrokuju gubitak do četvrtine svetskih useva. Oni takođe predstavljaju rizik za ljude i mogu biti fatalni za one sa oslabljenim imunološkim sistemom.
Naše najjače oružje protiv gljivičnih bolesti biljaka su azolni fungicidi. Ovi hemijski proizvodi čine do četvrtine svetskog tržišta poljoprivrednih fungicida, vrednih više od 3,8 milijardi dolara godišnje. Antifungalni azoli se takođe široko koriste kao tretman protiv patogenih gljivica koje mogu biti fatalne za ljude, što povećava njihov značaj u našem pokušaju da kontrolišemo gljivične bolesti.
Azoli ciljaju enzime u ćeliji patogena koji proizvode molekule slične holesterolu, nazvane ergosterol. Ergosterol je važna komponenta ćelijskih bio-membrana. Azoli iscrpljuju ergosterol, što dovodi do ubijanja ćelije patogena. Međutim, uprkos važnosti azola, naučnici malo znaju o stvarnom uzroku smrti patogena.
U novoj studiji objavljenoj u Nature Communications, naučnici Univerziteta u Ekseteru otkrili su ćelijski mehanizam kojim azoli ubijaju patogene gljivice. Rad je naslovljen „Azoli aktiviraju tip I i tip II programirane puteve ćelijske smrti kod patogenih gljiva useva. Koautori su dr Martin Šuster i dr Sreedhar Kilaru sa Univerziteta Ekseter.
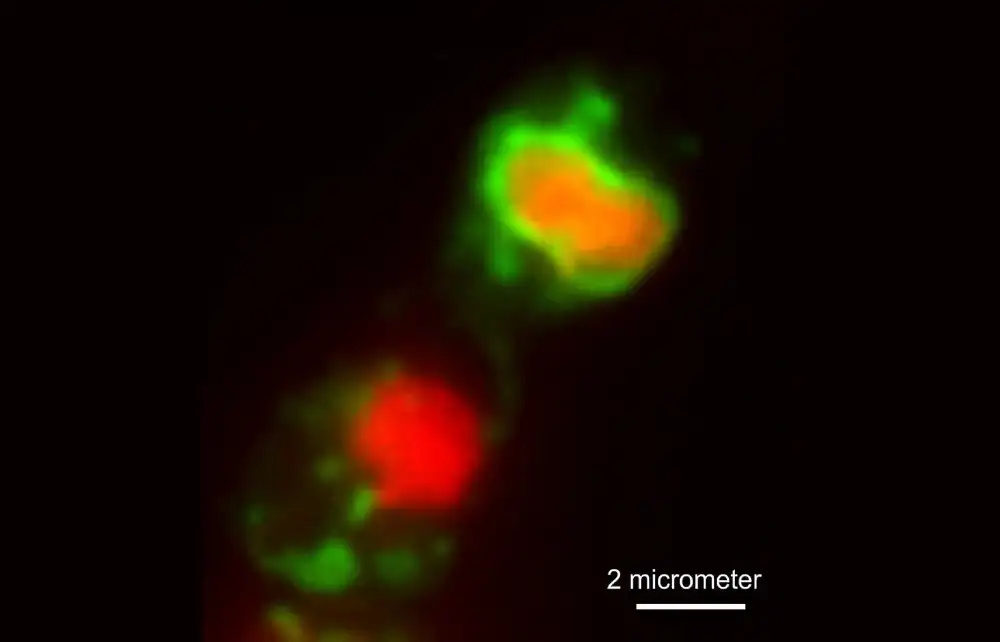
Tim istraživača, predvođen profesorom Gerom Steinbergom, kombinovao je pristupe slikanju živih ćelija i molekularnu genetiku da bi razumeo zašto inhibicija sinteze ergosterola dovodi do smrti ćelije u gljivici patogene kulture Zimoseptoria tritic (Z. tritici). Ova gljiva uzrokuje mrlje na listovima septorije na pšenici, ozbiljnu bolest u umerenim klimatskim uslovima, za koju se procenjuje da samo u Velikoj Britaniji uzrokuje više od 300 miliona dolara godišnje zbog gubitka žetve i prskanja fungicida.
Ekseter tim je posmatrao žive ćelije Z. tritici, tretirao ih poljoprivrednim azolima i analizirao ćelijski odgovor. Oni su pokazali da se prethodno prihvaćena ideja da azoli ubijaju ćeliju patogena izazivanjem perforacije spoljašnje ćelijske membrane ne primenjuje. Umesto toga, otkrili su da smanjenje ergosterola izazvano azolom povećava aktivnost ćelijskih mitohondrija, „elektrane“ ćelije, potrebne za proizvodnju ćelijskog goriva koje pokreće sve metaboličke procese u ćeliji patogena.
Iako proizvodnja više „goriva“ sama po sebi nije štetna, proces dovodi do stvaranja toksičnijih nusproizvoda. Ovi nusproizvodi pokreću program „samoubistva“ u ćeliji patogena, nazvan apoptoza. Pored toga, smanjeni nivoi ergosterola takođe pokreću drugi put „samouništenja“, koji uzrokuje da ćelija pojede sopstvena jezgra i druge vitalne organele – proces poznat kao makroautofagija. Autori pokazuju da oba puta ćelijske smrti podržavaju smrtonosnu aktivnost azola. Oni zaključuju da azoli teraju gljivičnog patogena u „samoubistvo“ pokretanjem samouništenja.
Autori su pronašli isti mehanizam da azoli ubijaju ćelije patogena u gljivici pirinča Magnaporthe orizae. Bolest koju izaziva ova gljiva ubija do 30% pirinča, esencijalnog useva za hranu za više od 3,5 milijardi ljudi širom sveta. Tim je takođe testirao druge klinički relevantne lekove protiv gljivica koji ciljaju na biosintezu ergosterola, uključujući terbinafin, tolfonat i flukonazol. Svi su inicirali iste odgovore u ćeliji patogena, što sugeriše da je ćelijsko samoubistvo opšta posledica inhibitora biosinteze ergosterola.
Glavni autor profesor Gero Steinberg, koji drži katedru za ćelijsku biologiju i direktor Centra za bioimadžing na Univerzitetu u Ekseteru, rekao je: „Naši nalazi prepisuju opšte razumevanje o tome kako azoli ubijaju gljivične patogene. Pokazujemo da azoli izazivaju ćelijsko ‘samoubistvo’ programi, koji rezultiraju samouništenjem patogena. Ova ćelijska reakcija se javlja nakon dva dana tretmana, što ukazuje na to da ćelije dostižu ‘tačku bez povratka’ nakon nekog vremena izlaganja azolima protiv azola, što objašnjava zašto otpornost na azole napreduje kod gljivičnih patogena, što znači da je veća verovatnoća da neće uspeti da ubiju bolest kod useva i ljudi.
„Naš rad baca svetlo na aktivnost naših najčešće korišćenih hemijskih agenasa za kontrolu patogena useva i ljudi širom sveta. Nadamo se da će se naši rezultati pokazati korisnim za optimizaciju strategija kontrole koje bi mogle spasiti živote i obezbediti sigurnost hrane za budućnost.“