Otkriće u vezi sa Mrc1 (Posrednik replikacijske kontrolne tačke 1) — fisionim proteinom kvasca koji je uključen u replikaciju DNK — objavljeno je u Cell. Otkriće je rezultat međunarodne istraživačke saradnje, koju vode profesorke Ženevjev Ton i Anja Grot sa Univerziteta u Kopenhagenu.
Dr Sebastijan Čarlton, zajednički prvi autor dela, je mnogo godina istraživao Mrc1 u laboratoriji Thon na Odeljenju za biologiju. „Znali smo da je ovaj protein važan za održavanje heterohromatskog stanja u ćelijama. Imali smo dobru ideju o tome kako funkcioniše, ali iako smo imali eksperimentalne podatke, nismo imali alate u našoj laboratoriji da to potvrdimo na molekularnom nivou, “ objašnjava on.
Da bi testirao svoju hipotezu naprednom genomikom koju je razvila laboratorija Groth, dr Čarlton je udružio snage sa dr Valentinom Flurijem, prvim autorom iz grupe Groth u Novo Nordisk fondacijskom centru za istraživanje proteina (CPR).
„Ali naša saradnja nije tu stala“, objašnjava on. „Takođe smo radili sa strukturalnim biolozima u CPR-u i sa istraživačima na Tokijskom Metropolitan Institutu za medicinske nauke i Hubreht institutu u Utrehtu. Ova uspešna saradnja ne samo da je dokazala našu početnu hipotezu, već je pokrenula i dalje eksperimente koji su otkrili iznenađujuću dualnost u funkciji Mrc1. .“
Kompleks za zaštitu viljuške (FPC) je grupa proteina, uključujući Mrc1 (Claspin kod ljudi), koji igraju ključnu ulogu u replikaciji DNK. Novo otkriće otkriva da FPC takođe reciklira roditeljske histone, sa njihovim specifičnim epigenetskim oznakama, na dva novosintetizovana lanca DNK. Ovaj proces je ključan za održavanje epigenetskog pamćenja, jer omogućava ćelijama kćeri da naslede isti epigenetski pejzaž kao roditeljska ćelija.
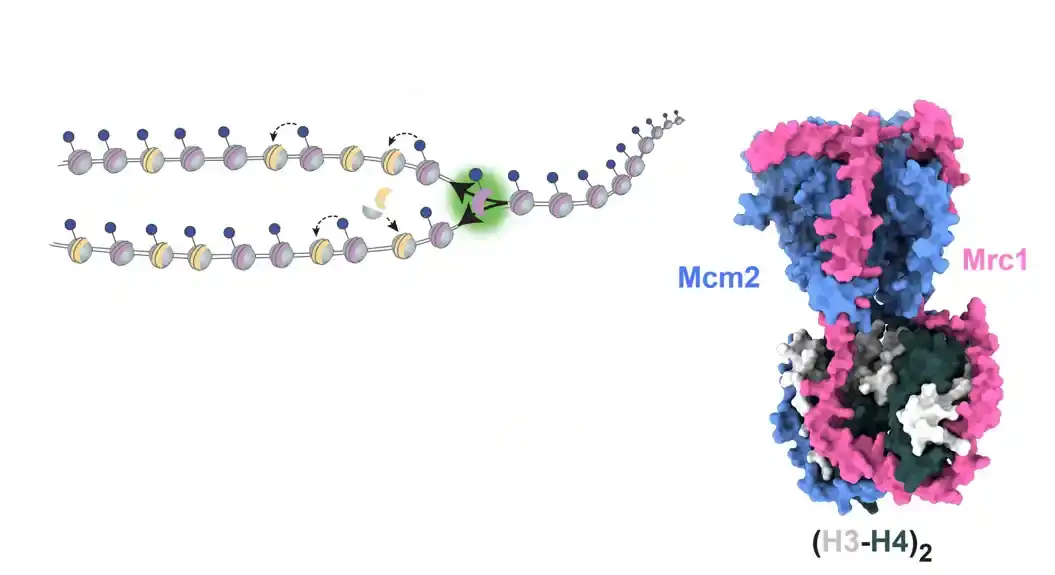
Eksperimenti dr Čarltona i Flurija su pokazali da, tokom replikacije DNK, Mrc1 deluje kao centralni koordinator roditeljskog nasleđivanja histona vezivanjem tetramera formiranog od histona H3 i H4.
Njihovo istraživanje je dalje pokazalo da mutacije u domenu ključnog konektora Mrc1 remete pravilnu distribuciju roditeljskih histona na zaostali lanac tokom replikacije DNK. Ovaj efekat je uporediv sa poremećajima uzrokovanim mutacijama u regionu Mcm2 koji se vezuje za histon – još jednog proteina za koji je već poznato da je uključen u reciklažu histona tokom replikacije DNK.
Istraživanja su uključila strukturna predviđanja AlphaFolda, potvrđena biohemijskom i funkcionalnom analizom, koja sugerišu da Mrc1 i Mcm2 kolaborativno vezuju H3-H4 tetramere, pri čemu domen konektora Mrc1 igra ključnu ulogu u povezivanju histona sa Mcm2. Dakle, Mrc1 i Mcm2 formiraju ko-šaperonski kompleks, obezbeđujući distribuciju histona na zaostali lanac tokom replikacije DNK.
Kod mutanta Mrc1, istraživači su otkrili da je utišavanje gena posredovano heterohromatinom H3K9me kompromitovano i, zapanjujuće, de-utišano aktivno stanje nasleđeno je asimetrično slično roditeljskim histonima. Ovaj nalaz naglašava važnost histona u prenošenju i prenošenju epigenetskih informacija, što održava stabilno utišavanje gena.
Dalje eksperimentalne analize su otkrile da zapravo Mrc1 žonglira histonima na više načina: domen konektora usmerava histone na zaostali lanac kao što je gore opisano, dok je drugi region koji vezuje histon potreban za recikliranje histona u vodeći lanac.
„Ranije nije bila poznata uloga Mrc1 u prenošenju roditeljskih histona. Sada smo pokazali da je Mrc1 neophodan za efikasno recikliranje histona u obe ćerke“, kaže dr Čarlton.
„Izgleda da Mrc1 prebacuje histone između zaostalih i vodećih lanaca DNK, delimično intra-replizom ko-chaperoning sa Mcm2. Ovo osigurava da obe ćerke ćelije nasleđuju ispravne epigenetske oznake, što je neophodno za očuvanje obrazaca ekspresije gena tokom ćelijske deobe .“
Održavanje pejzaža hromatina u mnogim generacijama ćelija je od vitalnog značaja za razvoj i održavanje više tipova ćelija u višećelijskim organizmima. Gubitak ćelijskog identiteta je osnovni uzrok mnogih bolesti kao što su rak i starenje, pri čemu dokazi sugerišu da se pejzaž hromatina vremenom pogoršava. Dr Fluri objašnjava da je istraživački tim imao „Eureka trenutak“ kada su mutirali mesta vezivanja histona u homologu Claspina kod sisara i primetili defekt u roditeljskom prenosu histona kao kod Mrc1 mutanata u fisionim ćelijama kvasca.
„Mislim da još uvek ne možemo da procenimo pun potencijal našeg otkrića, ali smo otkrili veoma fundamentalan mehanizam koji održava ćelijski identitet koji bi, ako se može manipulisati, mogao imati značajne implikacije za buduća medicinska istraživanja“, dr Fluri zaključuje.