Metode mašinskog učenja (ML) mogu brzo i precizno dijagnostikovati mutacije u gliomima — primarnim tumorima mozga. Ovo pokazuje nedavna studija Univerziteta zdravstvenih nauka Karl Landsteiner (KL Krems).
U ovoj studiji, objavljenoj u časopisu Rak, analizirani su podaci sa slika fiziometaboličke magnetne rezonance da bi se identifikovale mutacije u metaboličkom genu pomoću ML. Mutacije ovog gena imaju značajan uticaj na tok bolesti, a rana dijagnoza je važna za lečenje.
Studija takođe pokazuje da trenutno još uvek postoje nedosledni standardi za dobijanje slika fiziometaboličke magnetne rezonance, koji sprečavaju rutinsku kliničku upotrebu metode.
Gliomi su najčešći primarni tumori mozga. Uprkos još uvek lošoj prognozi, personalizovane terapije već mogu značajno poboljšati uspeh lečenja. Međutim, upotreba takvih naprednih terapija zasniva se na podacima o pojedinačnim tumorima, koji nisu lako dostupni za gliome zbog njihove lokacije u mozgu.
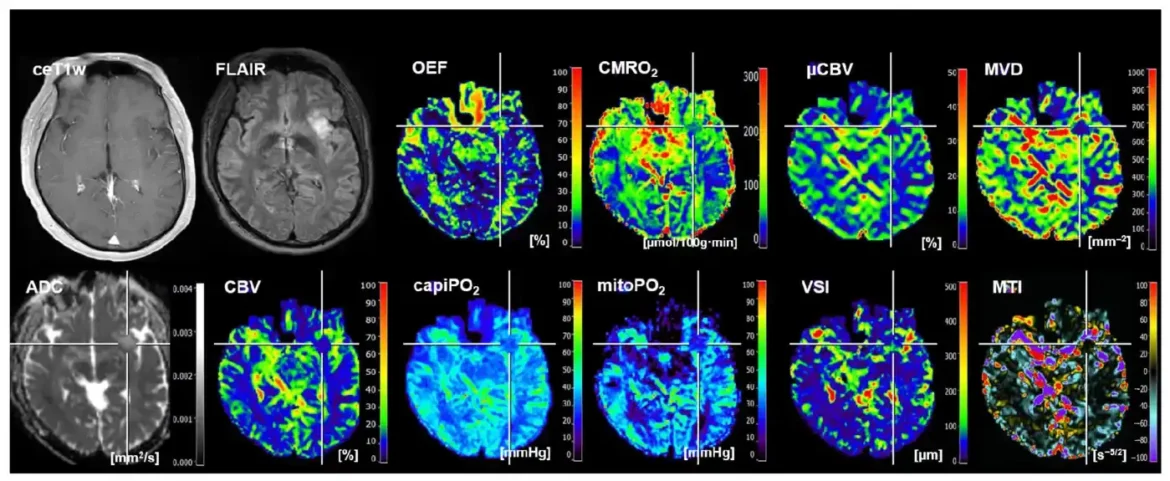
Tehnike snimanja kao što je magnetna rezonanca (MRI) mogu pružiti takve podatke, ali njihove analize su složene, zahtevne i dugotrajne.
Centralni institut za medicinsku radiološku dijagnostiku u Univerzitetskoj bolnici St. Pelten, nastavnom i istraživačkom mestu KL Kremsa, je stoga godinama razvijao metode mašinskog i dubokog učenja kako bi automatizovao takve analize i integrisao ih u rutinske kliničke operacije. Sada je postignut dalji napredak.
„Pacijenti čije ćelije glioma nose mutirani oblik gena za izocitrat dehidrogenazu (IDH) zapravo imaju bolje kliničke izglede od onih sa divljim oblikom“, objašnjava profesor Andreas Štadlbauer, medicinski fizičar sa Centralnog instituta. „To znači da što ranije znamo o ovom statusu mutacije, to bolje možemo individualizirati tretman.“
Razlike u energetskom metabolizmu mutiranih tumora i tumora divljeg tipa pomažu da se to postigne. Zahvaljujući ranijem radu tima prof. Stadlbauera, oni se mogu lako meriti korišćenjem fizio-metaboličke MRI, čak i bez uzoraka tkiva. Međutim, analiza i evaluacija podataka je veoma složen i dugotrajan proces koji je teško integrisati u kliničku rutinu, posebno zato što su rezultati potrebni brzo zbog loših prognoza pacijenata.
U trenutnoj studiji, tim je koristio ML metode da analizira i interpretira ove podatke kako bi brže dobio rezultat i mogao da započne odgovarajuće korake lečenja. Ali koliko su tačni dobijeni rezultati? Da bi se ovo procenilo, studija je prvo koristila podatke od 182 pacijenta u Univerzitetskoj bolnici St. Polten, čiji su MRI podaci prikupljeni u skladu sa standardizovanim protokolima.
„Kada smo videli rezultate procene pomoću naših algoritama ML“, objašnjava profesor Štadlbauer, „bili smo veoma zadovoljni. Postigli smo preciznost od 91,7% i tačnost od 87,5% u razlikovanju tumora sa genom divljeg tipa i sa mutiranim oblikom.
„Potom smo uporedili ove vrednosti sa ML analizama klasičnih kliničkih MRI podataka i uspeli smo da pokažemo da je upotreba fizio-metaboličkih MRI podataka kao osnove dala značajno bolje rezultate.
Međutim, ova superiornost je trajala samo dok su podaci prikupljeni u St. Poltenu analizirani prema standardizovanom protokolu. To nije bio slučaj kada je ML metoda primenjena na eksterne podatke, odnosno MRI podatke iz baza podataka drugih bolnica. U ovoj situaciji, ML metoda koja je obučena klasičnim kliničkim MRI podacima pokazala se uspešnijom.
„Činjenica da je ML analiza fizio-metaboličkih MRI podataka ovde lošija rezultat je činjenice da je tehnologija još uvek mlada i da je u fazi eksperimentalnog razvoja. Metode prikupljanja podataka i dalje variraju od bolnice do bolnice, što dovodi do izobličenja u ML analiza“, kaže Stadlbauer.
Za naučnika, međutim, problem je samo u standardizaciji, koja će se neizbežno pojaviti sa sve većom upotrebom fiziometaboličke MRI u različitim bolnicama. Sama metoda — procena fiziometaboličkih MRI podataka pomoću ML metoda koja štedi vreme — pokazala se odličnom.
Stoga je odličan pristup za određivanje statusa IDH mutacije pacijenata sa gliomom pre operacije i za individualizaciju opcija lečenja.