Biomedicinski inženjeri na Univerzitetu Duke razvili su novu tehniku za bolje razumevanje i testiranje tretmana za grupu izuzetno retkih poremećaja mišića koji se nazivaju disferlinopatija ili mišićne distrofije udova 2B (LGMD2B). Pristup uzgaja složeno, funkcionalno 3D mišićno tkivo iz matičnih ćelija u laboratoriji, stvarajući platformu koja replicira simptome pacijenata i odgovore na lečenje.
U svojoj debitantskoj studiji, istraživači otkrivaju neke od bioloških mehanizama koji leže u osnovi karakterističnog gubitka mobilnosti uzrokovanog LGMD2B. Oni takođe pokazuju da kombinacija postojećih tretmana može biti u stanju da ublaži neke od najgorih simptoma bolesti.
Rezultati se pojavljuju u časopisu Napredna nauka.
LGMD2B pogađa samo oko osam ljudi na milion širom sveta. Za razliku od poznatijeg i češćeg rođaka Duchenne mišićne distrofije, bolest pogađa i muškarce i žene, pojavljuje se kasnije u životu – u kasnim tinejdžerskim ili ranim 20-im – i retko je fatalna. Međutim, LGMD2B pacijenti razvijaju tešku slabost u nogama i ramenima, što obično zahteva da koriste invalidska kolica do kraja života.
Izazvan genetskim poremećajem, LGMD2B sprečava telo da stvori potpuno funkcionalan oblik proteina koji se zove disferlin. Trenutno ne postoje odobreni tretmani ili lekovi. Deo razloga za ovaj nedostatak opcija su mnoge funkcije disferlina, uključujući zaptivanje rupa u mišićnim membranama, regulisanje balansa kalcijuma potrebnog za kontrakciju mišića i kontrolu ćelijskog metabolizma. I iz nepoznatih razloga, pogođeni mišići u početku akumuliraju masnoću unutar samih mišićnih vlakana pre nego što se degenerišu i na kraju budu zamenjeni masnim ćelijama.
„Ova pojava je veoma retka čak i kod mišićnih distrofija“, rekao je Nenad Bursać, profesor biomedicinskog inženjerstva na Dukeu. „U zajednici je goruće pitanje zašto se to dešava.
Jedan od izazova sa kojima se suočavaju istraživači koji pokušavaju da reše ove probleme je taj što model miša koji se koristi za aproksimaciju LGMD2B pokazuje veoma blage simptome u poređenju sa pacijentima. Miševi sa bolešću i dalje mogu da hodaju, a ona se pojavljuje tek skoro godinu dana u njihovom dvogodišnjem životnom veku, što čini studije bolesti izuzetno sporim.
Disferlin se eksprimira u drugim tipovima ćelija, a nivoi metaboličkih goriva u krvi kao što je holesterol su takođe promenjeni kod miševa i pacijenata. Zajedno, ovo komplikuje LGMD2B istraživanje tako što otežava procenu koji su tipovi ćelija odgovorni za bolest i da li su metaboličke promene posledica gubitka samog disferlina ili efekata na celo telo.
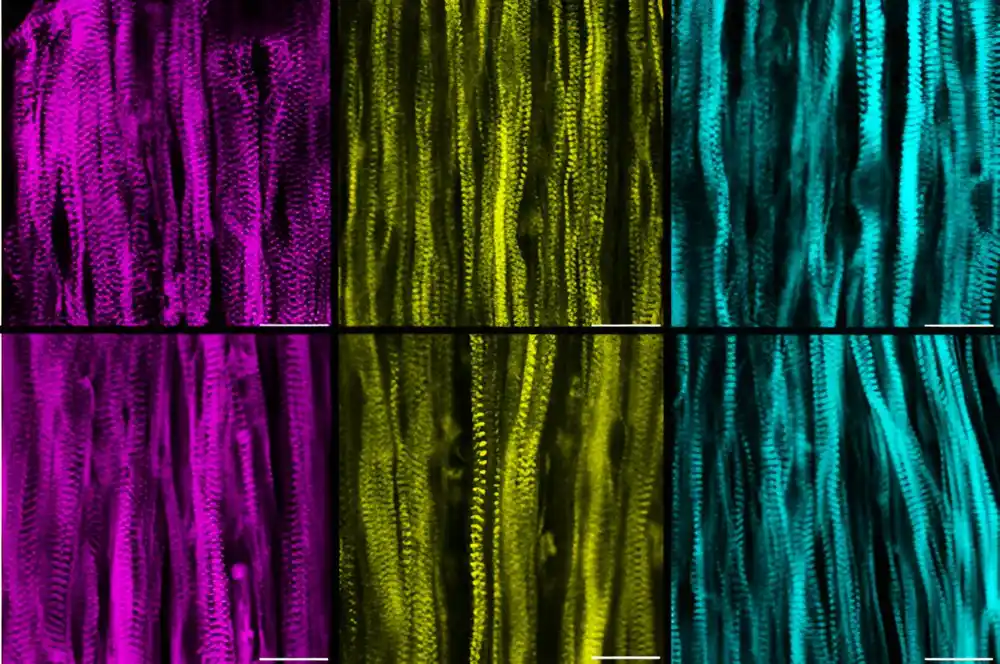
Da bi zaobišli ove izazove, Bursac i njegov naučnik Alastair Khodabukus okrenuli su se projektovanoj mišićnoj platformi koju su razvijali skoro deceniju. Laboratorija Bursac je prva koja je u Petrijevoj posudi razvila kontrakcijske, funkcionalne ljudske skeletne mišiće i od tada je poboljšavala svoje procese kako bi omogućila proučavanje mišićne snage, metabolizma i popravke. Ovaj sistem im je omogućio da fokusiraju svoje istraživanje samo na efekte disferlina na skeletne mišiće bez komplikacija drugih tipova ćelija ili izmenjenih profila metabolita u krvi.
U studiji, istraživači su započeli sa indukovanim pluripotentnim matičnim ćelijama (IPSC) dobijenim od pacijenata koji žive sa LGMD koje je obezbedila The Jain Foundation, dobrotvorna organizacija fokusirana na pronalaženje leka za LGMD2B. Koristeći svoje tehnike rasta mišića, laboratorija je ove matične ćelije sazrela u mišićna vlakna i provela ih kroz niz testova tokom šest nedelja.
Poput mišića koji se nalaze kod samih pacijenata, verzije koje su uzgajane u laboratoriji su pokazale širok spektar problema.
„Sve u svemu, naš model je ponovio mnogo kliničkih manifestacija bolesti i zapažanja napravljenih kod stvarnih pacijenata, ali je sve urađeno u Petrijevoj posudi“, rekao je Bursać. „Uspeli smo da steknemo nove uvide u aspekte bolesti specifične za mišiće.“
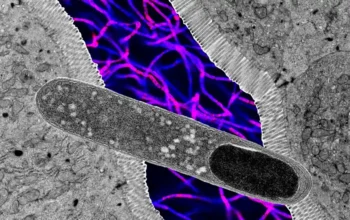
Istraživači su otkrili da gubitak mišićne snage nije rezultat nedostataka u strukturi ili veličini mišića, već u rukovanju kalcijumom. Kontrakcije mišića su fizički uzrokovane oslobađanjem rezervoara kalcijuma u mišićnim ćelijama i vezivanjem za mišićne proteine. Testovi su pokazali da su bolesne mišićne ćelije izazvale curenje u svojim rezervama kalcijuma, što je rezultiralo manje oslobađanja kalcijuma i slabijim kontrakcijama.
Istraživači su takođe pokazali da je nedostatak disferlina prouzrokovao oštećenje mišićnih ćelija da ostane nepopravljeno i da je nemogućnost sagorevanja masnih kiselina za proizvodnju energije barem delimično kriva za akumulaciju masti u mišićnim vlaknima koja je dugo zbunjivala medicinu. zajednica.
„Replicirali smo nešto što smo videli kod pacijenata i pokazali da to nije zbog faktora životne sredine u telu, već problema u samim mišićima“, rekao je Khodabukus.
Istraživači su zatim testirali efekte dva kandidata za lek za potencijalno lečenje bolesti koje su identifikovane preko mišjih modela, ali još uvek nisu testirane na ljudima. Jedan koji se zove dantrolen bi trebalo da spreči curenje kalcijuma iz rezervoara mišićnih ćelija. Drugi, nazvan vamorolon, nedavno je odobren za upotrebu kod pacijenata sa Dušenovom mišićnom distrofijom, iako istraživači ne razumeju u potpunosti kako funkcioniše.
Zajedno, lekovi su sprečili curenje kalcijuma i pomogli da se ćelijska membrana popravi, vraćajući veći deo snage mišića. I dok su takođe pomogli u smanjenju količine masti akumulirane u mišićima, nisu je u potpunosti sprečili, niti su pomogli mišićima da efikasno sagorevaju masti kao gorivo.
Idući dalje, grupa planira da doda imune i masne ćelije u svoje eksperimente radi veće složenosti. Oni takođe žele da dalje razumeju poremećaje ćelijskog metabolizma i da pronađu nove lekove koji u potpunosti vraćaju svu snagu, popravku i metabolički deficit.
„Trenutno imamo osnovni sistem samo za mišiće, koji je sjajan za uočavanje efekata bolesti unutar samog mišića, ali ono što je takođe važno je preslušavanje između imunih ćelija, masnih ćelija i mišićnih ćelija“, rekao je Khodabukus. „Izgradnjom našeg sistema više, nadamo se da ćemo moći u potpunosti da shvatimo šta pokreće gubitak mišića i njegovu zamenu masnoćom kod ovih pacijenata.“