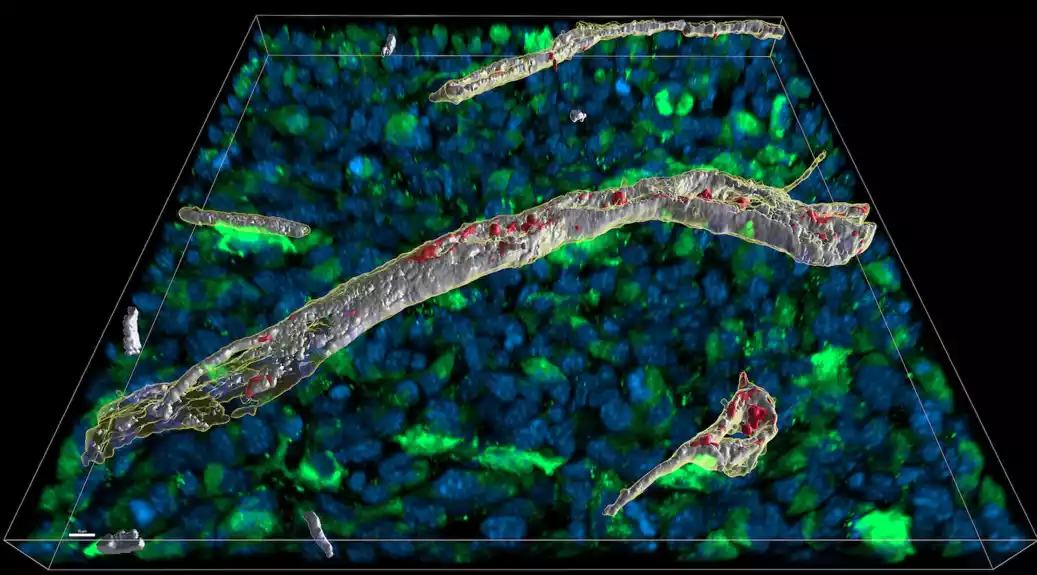
Signalni molekuli imunog sistema treba da izazovu odgovor samo tamo gde je to neophodno. Da bi se sprečilo po život opasno širenje na ostatak tela, vezivno tkivo može da apsorbuje ove molekule poput sunđera. Tim predvođen Tomasom Blankenštajnom predstavlja ovaj mehanizam u časopisu Nature Immunology.
Kada T ćelije imunog sistema komuniciraju, one to čine uz pomoć citokina. Važan član porodice citokina je interferon-gama — protein koji aktivira odbranu tela, posebno u borbi protiv virusa i bakterija.
Tokom evolucije, ljudsko telo je razvilo različite strategije kako bi sprečilo da imuni odgovor premaši svoj cilj. Još jedan važan mehanizam sada je otkrio nemačko-francuski istraživački tim na čelu sa profesorom Tomasom Blankenštajnom, šefom Laboratorije za molekularnu imunologiju i gensku terapiju u berlinskom centru Maks Delbrik.
U radu objavljenom u časopisu Nature Immunologi, naučnici objašnjavaju kako interferon-gama koristi četiri aminokiseline da se veže za ekstracelularni matriks vezivnog tkiva, koje formira mrežu između pojedinačnih ćelija i tako posreduje međućelijski kontakt. Prvi autor studije, dr Džozefin Kemna, objašnjava da ovo vezivanje sprečava da se citokin širi po celom telu i izazove opasne imunološke reakcije.
Kada nedostaju aminokiseline potrebne za vezivanje, kaže ona, rezultat je ozbiljno oštećenje odbrane tela. Kemna je bila član Blankenštajnovog tima od 2017. do 2022. Prošle godine se preselila u berlinsku biotehnološku kompaniju T-knife Therapeutics—spin-off iz Blankenštajnove laboratorije. Kemna je doktorirala ovom najnovijom studijom, u kojoj je Charite—Universitatsmedizin Berlin takođe imala ključnu ulogu. Istraživanje je podržano grantom Fondacije Vilhelm Sander.
Polazna tačka za studiju bilo je zapažanje Blankenštajna i njegovog tima pre nekoliko godina: „Primetili smo da se molekularna struktura citokina interferon-gama u velikoj meri razlikuje od vrste do vrste“, objašnjava dr Tomas Kamertons, još jedan član tim koji takođe radi na Institutu za imunologiju u Šariteu.
Rukovodio je Kemninom doktorskom tezom zajedno sa Blankenštajnom i naveden je kao poslednji autor. „Međutim, jedna kratka sekvenca od četiri aminokiseline, poznata kao KRKR motiv, ostala je praktično nepromenjena tokom čitave evolucije kičmenjaka – to jest, preko 450 miliona godina – u svih 50 vrsta koje smo proučavali.“ Na osnovu ovog nalaza, tim je zaključio da KRKR motiv mora igrati važnu ulogu u funkciji citokina – i odlučio je da testira ovu hipotezu.
Istraživači su počeli da koriste model miša koji je razvio Kammertons, koji im je omogućio da regulišu koncentraciju interferona-gama koji je proizveden. „Već smo mogli da utvrdimo iz ovog modela da interferon-gama postaje toksičan veoma brzo i da životinje sa visokom koncentracijom ovog signalnog molekula u krvi obole u roku od nekoliko dana“, objašnjava Kamertons.
Biohemijske analize su takođe otkrile da kada se protein izlučuje preko T ćelija sa svoje četiri pozitivno naelektrisane aminokiseline, on se vezuje za negativno naelektrisan ekstracelularni matriks – naime, za molekul heparan sulfata.
„Ovo osigurava da se interferon-gama zadržava lokalno i sprečava njegovo širenje po telu“, kaže Kamertons. Međutim, s obzirom na to da se struktura heparan sulfata razlikuje u zavisnosti od tkiva, tipa ćelije ili čak stanja ćelije, sposobnost vezivnog tkiva da veže interferon-gama takođe može da varira, dodaje profesor Hug Lorta-Jakob sa Univerziteta Grenobl-Alpi, koji takođe je bio uključen u studiju.
U sledećem koraku, grupa se obratila dr Ralfu Kunu, šefu Laboratorije za uređivanje genoma i modela bolesti u Centru Maks Delbrik, da pomogne u razvoju modela koji bi proizvodio molekule interferona bez KRKR motiva. Da bi to uradili, Kuhn i njegov tim su uklonili četiri aminokiseline iz citokina kod miševa koristeći tehniku za uređivanje gena CRISPR-Cas9.
„Dugo vremena, naučnici su verovali da signalni molekul zavisi od ovog mesta vezivanja da uopšte funkcioniše“, kaže Kamertons. „Dakle, prvo smo morali da dokažemo da to nije slučaj. I tim je zaista bio u stanju da pokaže da se, čak i bez motiva KRKR, interferon-gama i dalje vezuje za svoj receptor na površini ćelija i obavlja svoju uobičajenu ulogu u imunološkom odgovoru.
Obično bi se imuni sistem tada borio protiv virusne infekcije i na kraju je eliminisao. Međutim, za miševe kojima nedostaju četiri aminokiseline u interferonu-gama, to nije bio slučaj. „Imuni sistem životinja je još uvek bio u stanju da reguliše imune odgovore na viruse koji izazivaju samo vrlo kratke inflamatorne reakcije“, izveštava Kamertons, rekavši da se u ovim slučajevima količina interferona-gama u krvi u početku povećala, ali je onda ponovo veoma opala. brzo.
„Ipak, kada su miševi bili zaraženi LCM virusima, koji izazivaju bolest sličnu gripu zvanu limfocitni horiomeningitis i drže imuni sistem zauzetim tokom dužeg vremenskog perioda, miševi uređeni genima brzo su se razboleli zbog visokih koncentracija interferona. gama u njihovoj krvi“.
„Po mom mišljenju, jasno je iz našeg istraživanja da je naš imuni sistem razvio veoma moćne mehanizme da drži sopstvenu odbranu pod kontrolom“, kaže prvi autor Kemna. Ako ovi mehanizmi ne funkcionišu kako treba, kaže ona, imuni sistem može na kraju oštetiti sopstveni organizam zbog toksičnog efekta određenih molekula dok se nastavljaju širiti.
„Mehanizam koji smo otkrili pokazuje da je evolucija osigurala da toksični molekuli generalno deluju samo tamo gde su potrebni – to jest, tamo gde T ćelija prepoznaje ćeliju zaraženu virusom.“
„Ova studija je od fundamentalnog značaja za imunologiju i naše razumevanje mnogih inflamatornih bolesti u ljudskom telu“, kaže Kamertons. On takođe objašnjava da ekstracelularni matriks ima različitu strukturu kod muškaraca i žena, pa bi novootkriveni mehanizam mogao da objasni zašto neke zarazne i autoimune bolesti tako različito napreduju kod muškaraca i žena.
„Nikada ne bismo došli do ovih novih otkrića bez izvanredne saradnje sa našim francuskim kolegom Huguesom Lortat-Jacobom, koji istražuje ekstracelularne matrice više od 30 godina i jedan je od vodećih svetskih stručnjaka u ovoj oblasti“, dodaje Kamertons.
Kamertons sada planira sledeću fazu studije sa vođom svoje grupe Blankenštajnom i naučnicima iz Univerzitetskog medicinskog centra u Frajburgu. Zajedno će testirati svoja najnovija otkrića na novom modelu. „Želimo da radimo sa takozvanim divljim miševima – miševima koji su već prošli nekoliko infekcija i čiji imuni sistem stoga izaziva odgovor sličniji ljudskom“, kaže Kamertons.
„Tokom svoje evolucije, imuni sistem je razvio sve moćnije oružje u svojevrsnoj trci u naoružanju protiv patogena“, rezimira Blankenštajn. „Naš rad je otkrio novi mehanizam koji deluje kao protivteža ovom arsenalu oružja bez smanjenja efikasnosti imunološkog odgovora — samo četiri aminokiseline u interferonu-gama sprečavaju zarazne bolesti da izazovu mnogo više smrti.
Stoga ima smisla nastaviti dalje da bismo bolje razumeli tačne detalje interakcije između interferona-gama i ekstracelularnog matriksa.