Novo istraživanje pruža uvid u to kako enzim koji pomaže u regulisanju starenja i drugih metaboličkih procesa pristupa našem genetskom materijalu da bi modulirao ekspresiju gena unutar ćelije. Tim predvođen istraživačima Penn State-a proizveo je slike sirtuinskog enzima vezanog za nukleozom – čvrsto zbijeni kompleks DNK i proteina koji se nazivaju histoni – pokazujući kako enzim upravlja nukleozomskim kompleksom da bi pristupio i DNK i histonskim proteinima i pojašnjavajući kako funkcioniše. kod ljudi i drugih životinja.
Rad koji opisuje rezultate pojavljuje se 14. aprila u časopisu Science Advances.
Sirtuini su vrsta enzima koji se nalazi u organizmima u rasponu od bakterija do ljudi koji igraju važnu ulogu u starenju, otkrivanju oštećenja DNK i suzbijanju tumora kod različitih karcinoma. Zbog ovih različitih uloga, farmaceutske kompanije istražuju svoj potencijal za biomedicinske primene. Mnogo truda je usredsređeno na sposobnost nekih sirtuina da smanje ekspresiju gena uklanjanjem hemijske zastave sa histonskih proteina.
„U našim ćelijama DNK nije gola kao što to vidimo u udžbenicima; ona je umotana oko proteina zvanih histoni unutar velikog kompleksa zvanog nukleosom“, rekao je Song Tan, Verne M. Villaman profesor molekularne biologije u Penn State i autor papira. „Ovo pakovanje takođe može da doprinese signalima za uključivanje ili isključivanje gena: dodavanje ‘acetil’ hemijske zastavice na materijal za pakovanje histona uključuje gen, dok uklanjanje acetil zastavice isključuje gen. Sirtuini mogu utišati aktivnost gena uklanjanjem acetil zastavica iz histona upakovanih u nukleozome. Razumevanje načina na koji sirtuini stupaju u interakciju sa nukleozomom da bi uklonili ovu zastavicu moglo bi da informiše buduće napore u otkrivanju lekova.“
Prethodne studije su se fokusirale na to kako sirtuini interaguju sa kratkim segmentima histona u izolaciji, delom zato što je sa takvim histonskim „repnim“ peptidima mnogo lakše raditi u laboratoriji. Prema Tanu, nukleozom je sto puta veći od tipičnih histonskih peptida koji se koriste u ovim studijama i zbog toga je mnogo komplikovaniji za rad.
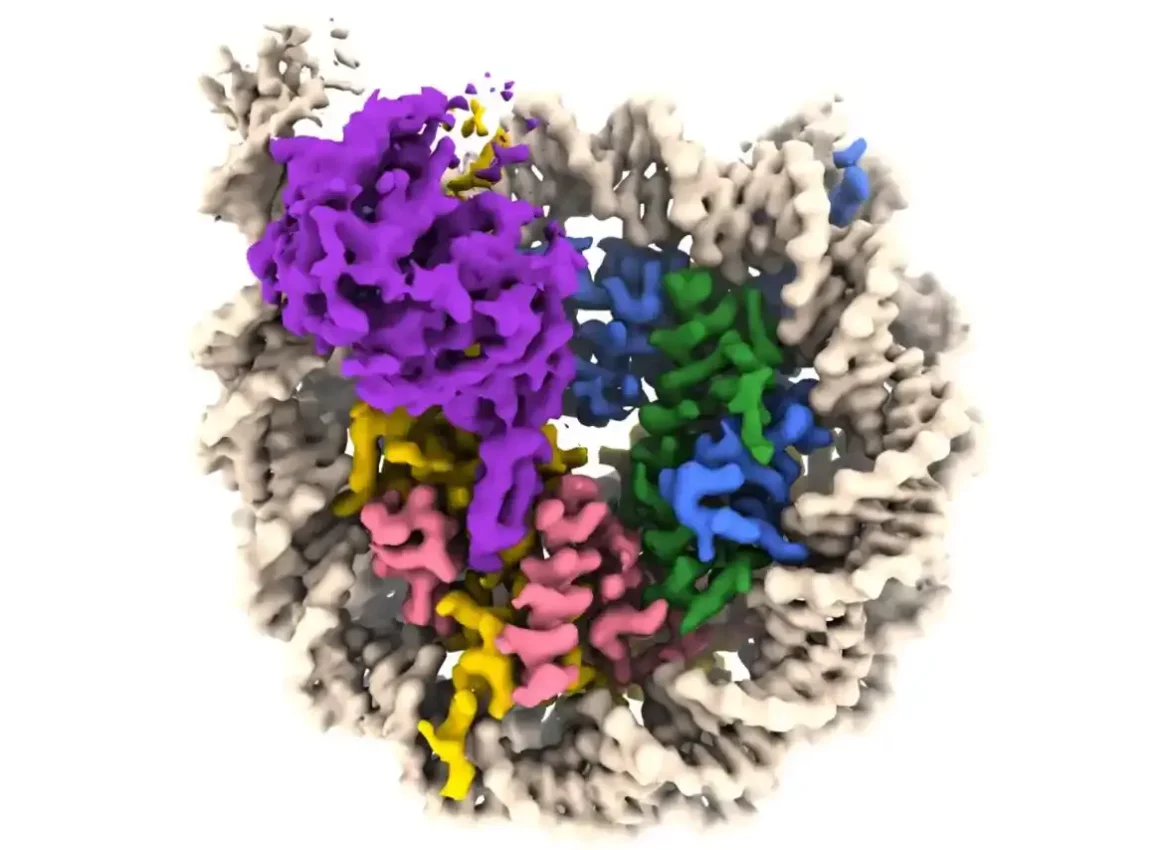
„Vizuelizirali smo enzim sirtuina nazvan SIRT6 na njegovom fiziološki relevantnom supstratu – čitavom nukleozomu,“ rekao je Jean-Paul Armache, docent biohemije i molekularne biologije u Penn State-u i autor rada. „I otkrili smo da SIRT6 reaguje sa više delova nukleozoma, a ne samo sa histonom gde treba modifikovati zastavicu acetila.“
Koristeći moćnu vrstu slike koja se zove krio-elektronska mikroskopija sa instrumentima u Penn State Crio-Electron Microscopi Faciliti, Nacionalnom institutu za rak i Pacifičkom severozapadnom Crio-EM centru, istraživači su identifikovali kako se SIRT6 pozicionira na nukleozomu kako bi uklonio acetil grupa sa pozicije K9 na histonu pod nazivom H3. Praćenje biohemijskih eksperimenata – u saradnji sa laboratorijom Craig Peterson na Medicinskom fakultetu Univerziteta Massachusetts Chan – pomoglo je da se potvrde njihovi rezultati.
Istraživači su otkrili da se SIRT6 vezuje za nukleozom koristeći vrstu veze koja se naziva „arginin sidro“. Ovu vrstu vezivanja — koju je opisao Tanova laboratorija 2014. — koriste različiti proteini koji ciljaju na posebno kiseli deo na površini nukleozoma. U ovom slučaju, strukturna karakteristika SIRT6 koja se zove produžena petlja ugnezdi se u udubljenje u kiseloj površini, nešto kao cev koja se nalazi u jarku.
„Argininsko sidro je uobičajena paradigma koliko proteina hromatina interaguje sa nukleozomom“, rekao je Tan. „Kada smo mutirali SIRT6 argininsko sidro, aktivnost na poziciji K9 je bila ozbiljno pogođena, podržavajući kritičnu ulogu SIRT6-ovog argininskog sidra. Iznenađujuće, ova mutacija je takođe uticala na enzimsku aktivnost SIRT6 na drugoj poziciji, K56, koja se nalazi mnogo dalje. “
Umesto da se SIRT6 vezuje za nukleozom na dva različita načina da bi pristupio dvema različitim pozicijama histona, moguće je da se SIRT6 vezuje za pristup K9 na način koji bi takođe mogao da obezbedi pristup K56.
„SIRT6 se vezuje za delimično neumotani nukleozom, sa DNK izmeštenom sa kraja nukleozoma“, rekao je Armaš. „Ovo otkriva poziciju K56 i moguće je da bi se SIRT6 u suštini mogao nagnuti da bi dostigao tu poziciju. Želeli bismo da potvrdimo ovu hipotezu u budućnosti. Takođe se nadamo da ćemo istražiti kako SIRT6 funkcioniše zajedno sa drugim enzimima i da bolje razumemo njegovu ulogu u odgovoru na oštećenje DNK.“