U današnjem medicinskom okruženju, antibiotici su ključni u borbi protiv bakterijskih infekcija. Ova moćna jedinjenja, koja proizvode bakterije i gljive, deluju kao prirodna odbrana od napada mikroba. Tim istraživača je ušao u zamršeni svet glikopeptidnih antibiotika – vitalnog resursa u borbi protiv patogena otpornih na lekove – da bi otkrio njihovo evoluciono poreklo.
Dr Demi Iftime i dr Martina Adamek predvodile su ovaj interdisciplinarni projekat, pod vođstvom profesora Evi Stegmann i Nadine Ziemert iz Klastera izvrsnosti „Kontrola mikroba u borbi protiv infekcija“ na Univerzitetu u Tibingenu, uz podršku profesora Maksa Krajla i dr Matijasa Hansen sa Univerziteta Monaš u Australiji.
Koristeći naprednu bioinformatiku, tim je pokušao da dešifruje hemijski nacrt drevnih glikopeptidnih antibiotika. Razumevanjem njihove evolucione putanje, istraživači su tražili uvide koji bi mogli da usmere razvoj budućih antibiotika za medicinsku primenu. Studija tima objavljena je u Nature Communications.
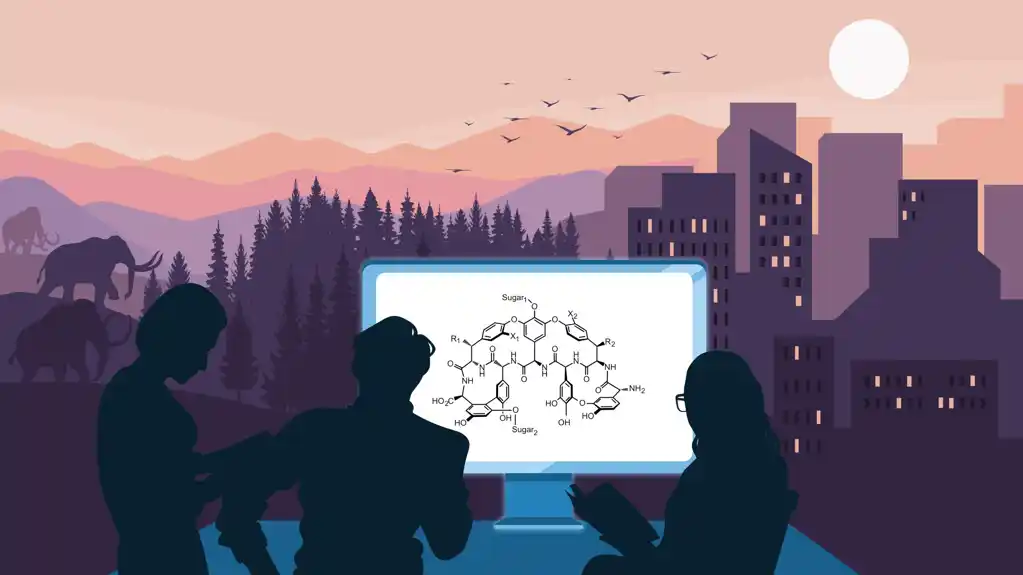
„Antibiotici nastaju iz tekućeg evolucionog natezanja između različitih organizama, od kojih svaki nastoji da nadmaši ili ograniči širenje svojih protivnika“, objašnjava Evi Stegman. Da bi ovo istražili, istraživači su koristili glikopeptidne antibiotike teikoplanin i vankomicin, zajedno sa srodnim jedinjenjima koja potiču iz specifičnih bakterijskih sojeva.
Ova jedinjenja, izgrađena od aminokiselina i šećera, ometaju izgradnju ćelijskog zida bakterija, što na kraju dovodi do smrti bakterija. Značajno je da teikoplanin i vankomicin pokazuju ovu moć protiv brojnih ljudskih patogena.
Pojednostavljeno rečeno, naučnici često organizuju vrste u evolucionu strukturu drveta kako bi ilustrovali njihove odnose. Slično tome, istraživački tim je konstruisao porodično stablo poznatih glikopeptidnih antibiotika, povezujući njihove hemijske strukture preko klastera gena koji kodiraju njihove nacrte. Koristeći bioinformatičke algoritme, oni su zaključili navodni oblik predaka ovih antibiotika – koji su nazvali „paleomicin“.
Rekonstruišući genetske puteve za koje su verovali da proizvode paleomicin, tim je uspešno sintetizovao jedinjenje, koje je pokazalo antibiotska svojstva u testovima. „Ponovno kreiranje tako drevnog molekula bilo je uzbudljivo, slično vraćanju dinosaurusa ili vunastih mamuta u život“, kaže Zimert.
„Jedan intrigantan nalaz je da svi glikopeptidni antibiotici potiču od zajedničkog prekursora“, kaže Stegmann.
„Štaviše, struktura jezgra paleomicina odražava kompleksnost teikoplanina, dok vankomicin pokazuje jednostavnije jezgro. Spekulišemo da je nedavna evolucija pojednostavila strukturu potonjeg, ali je njegova antibiotska funkcija ostala nepromenjena“, dodaje Zimert.
Ova porodica antibiotika — iako je korisna za bakterije koje ih proizvode — zahteva značajnu energiju zbog svog složenog hemijskog sastava. Racionalizacija ove složenosti uz zadržavanje efikasnosti mogla bi doneti evolucionu prednost.
Istraživači su pažljivo pratili evoluciju ovih antibiotika i njihove genetske sekvence, istražujući ključne korake potrebne za stvaranje funkcionalnih molekula. U saradnji sa australijskim naučnicima, neki od ovih koraka su replicirani u laboratorijskim uslovima.
„Ovo putovanje kroz vreme otkrilo je duboke uvide u evoluciju puteva bakterijskih antibiotika i strategije optimizacije prirode, što je dovelo do savremenih glikopeptidnih antibiotika“, kaže Zimert. „Ovo nam pruža čvrstu osnovu za unapređenje ove ključne grupe antibiotika koristeći biotehnologiju.“