Prime editing, svestrani oblik uređivanja gena koji može da ispravi većinu poznatih genetskih mutacija koje izazivaju bolesti, sada ima novo sredstvo za isporuku svoje mašinerije u ćelije živih životinja.
Tim istraživača sa Instituta Broad MIT-a i Harvarda konstruisao je čestice slične virusu da isporuče glavne urednike ćelijama kod miševa sa dovoljno visokom efikasnošću da spase genetski poremećaj. U novom radu objavljenom u Nature Biotechnologi, tim je prilagodio konstruisane čestice slične virusima (eVLP) koje su prethodno dizajnirali da nose osnovne editore — još jedan tip preciznog uređivača gena koji pravi promene u jednom slovu u DNK.
Sada istraživači opisuju kako su rekonstruisali i eVLP-ove i delove glavnog proteina za uređivanje i RNK mašinerije da bi povećali efikasnost uređivanja do 170 puta u ljudskim ćelijama u poređenju sa prethodnim eVLP-ovima koji isporučuju osnovne editore.
Tim je koristio svoj novi sistem da ispravi mutacije koje izazivaju bolesti u očima dva mišja modela genetskog slepila, delimično vraćajući im vid. Oni su takođe isporučili glavne urednike mišjem mozgu i nisu otkrili nijedno uređivanje van cilja.
„Ova studija predstavlja prvi put prema našem saznanju da je isporuka proteinsko-RNA kompleksa korišćena za postizanje terapijskog primarnog uređivanja kod životinje“, rekao je David Liu, stariji autor studije i profesor Richard Merkin i direktor Instituta Merkin. Transformativne tehnologije u zdravstvu u širem smislu. Liu je takođe istraživač na Medicinskom institutu Hauard Hjuz i profesor na Univerzitetu Harvard.
Pristupi za uređivanje gena obećavaju da će lečiti niz bolesti preciznim ispravljanjem genetskih mutacija koje uzrokuju bolest. Prvo uređivanje, koje je 2019. godine opisala Liuova grupa, može napraviti duže i raznovrsnije tipove DNK promena od drugih vrsta uređivanja. Međutim, isporuka složene mašinerije za uređivanje gena ćelijama živih životinja je bila izazovna.
Glavni sistem za uređivanje ima tri komponente: protein Cas9 koji može da odseče DNK; projektovani glavni vodič za uređivanje RNA (pegRNA) koji specificira lokaciju uređivanja i takođe sadrži novu uređenu sekvencu za instaliranje na toj lokaciji; i reverzna transkriptaza koja koristi pegRNK kao šablon da napravi specifične promene u DNK.
Istraživači su koristili različite metode za isporuku ovih molekularnih mašina ćelijama, uključujući lipidne nanočestice i viruse. Virusne čestice (VLP), sastavljene od omotača virusnih proteina koji nose teret, ali nemaju virusni genetski materijal, takođe su od posebnog interesa. Ali VLP-ovi tradicionalno daju skromne rezultate isporuke kod životinja i moraju biti posebno projektovani za svaku različitu vrstu tereta da bi se efikasno isporučili ćelijama.
„U početku smo se nadali da možemo samo da uzmemo eVLP-ove koje smo mukotrpno razvili i optimizovali za osnovno uređivanje i da ih primenimo na glavne urednike“, rekao je Meirui An, diplomirani student u laboratoriji Liu i prvi autor novog rada. „Ali kada smo to pokušali, nismo primetili skoro nikakvu osnovnu montažu.“
U novom radu, istraživači su opsežno rekonstruisali i eVLP proteine i samu glavnu mašinu za uređivanje, tako da su sistemi za isporuku i uređivanje radili efikasnije. Na primer, poboljšali su način na koji je glavni materijal za uređivanje bio upakovan u eVLP-ove, kako je odvojen od vozila za isporuku i kako je isporučen u jezgra ciljnih ćelija.
„Teret glavnog urednika mora biti efikasno upakovan u eVLP-ove kada se čestice formiraju, ali takođe mora biti efikasno oslobođen od čestica nakon ulaska u ciljnu ćeliju“, rekao je Aditia Raguram, bivši diplomirani student Liu laboratorije i koautor studije. „Svi ovi koraci moraju biti pažljivo orkestrirani kako bi se postiglo efikasno eVLP posredovano primarno uređivanje.“
Dok je svako pojedinačno poboljšanje dovelo do malih skokova u efikasnosti glavnih urednika, promene su zajedno imale mnogo veći uticaj.
„Kada smo sve kombinovali, videli smo poboljšanja od otprilike 100 puta u poređenju sa eVLP-ovima sa kojima smo počeli“, rekao je Liu. „Takva vrsta poboljšanja efikasnosti bi trebalo da bude dovoljna da nam pruži terapeutski relevantne nivoe primarnog uređivanja, ali nismo znali sa sigurnošću dok to nismo testirali na životinjama.
Liu i njegove kolege, u saradnji sa Kšištofom Palčevskim sa Univerziteta Kalifornije, Irvine, prvo su testirali sistem na miševima kako bi ispravili dve različite genetske mutacije u očima. Jedna mutacija, u genu Mfrp, uzrokuje bolest zvanu retinitis pigmentosa koja dovodi do progresivne degeneracije mrežnjače. Drugi, u genu Rpe65, povezan je sa slepilom u stanju poznatom kao Leberova kongenitalna amauroza (LCA) kod ljudi.
U oba slučaja, eVLP-ovi su korigovali mutaciju u do 20% ćelija mrežnjače životinja, delimično vraćajući im vid.
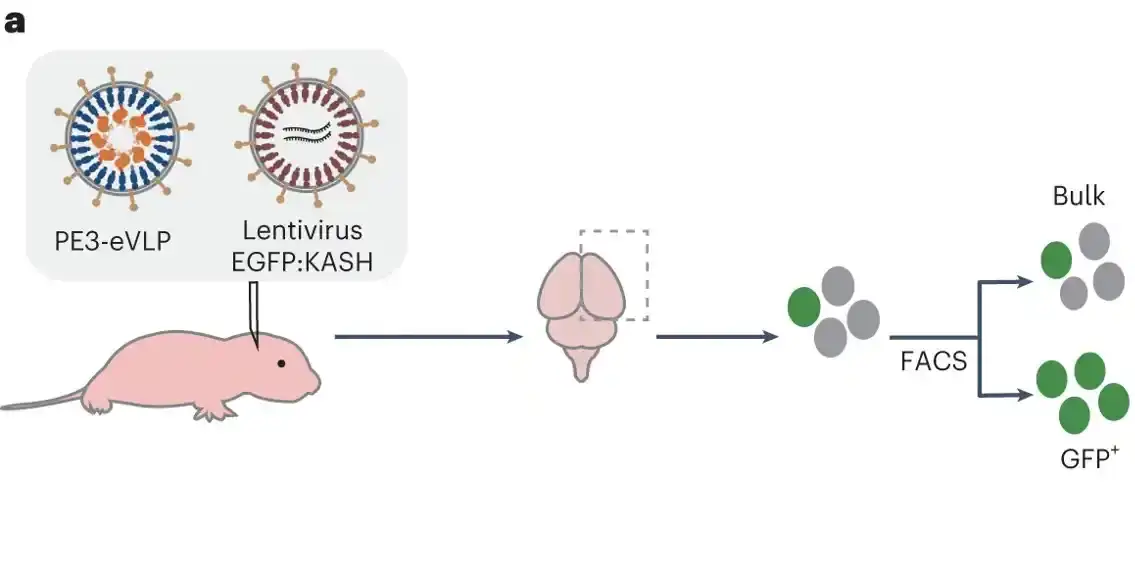
Istraživačka grupa je takođe pokazala da eVLP-ovi napunjeni osnovnom mašinom za uređivanje mogu efikasno uređivati gene u mozgu živih miševa. Skoro polovina svih ćelija u korteksu mozga koje su primile mašineriju za uređivanje pokazala je izmenu gena.
„Polje za uređivanje gena se u velikoj meri slaže da, krećući se u budućnost, mašine za uređivanje gena treba na kraju da budu isporučene kao proteini kako bi se minimizirali potencijalni neželjeni efekti i sada smo pokazali efikasan način da to uradimo“, rekao je Liu. „Planiramo da nastavimo da aktivno radimo na poboljšanju eVLP-a i prilagođavanju tehnologije za ciljanje drugih tipova tkiva u telu.“