Nova otkrića objavljena u Američkom časopisu za patologiju impliciraju faktor koji stimuliše koloniju granulocita (G-CSF) i kod bronhopulmonalne displazije i kod retinopatije kod prevremeno rođenih beba.
Napredak u brizi o prevremeno rođenim bebama dovodi do poboljšanih stopa preživljavanja. Međutim, povećava se učestalost neonatalnih bolesti sa doživotnim posledicama, kao što su bronhopulmonalna displazija (BPD) i retinopatija nedonoščadi (ROP). Nova studija je uključila faktor koji stimuliše koloniju granulocita (G-CSF) i u BPD i u ROP, što ga čini obećavajućim terapijskim kandidatom.
BPD, takođe nazvana hronična bolest pluća nezrelosti, pogađa otprilike jednu trećinu svih visoko nedonoščadi, uzrokujući doživotno oštećenje pluća. Javlja se kod otprilike 80% novorođenčadi rođene između 22. i 24. nedelje gestacije. Ne postoji efikasan tretman osim potporne nege. BPD se često javlja zajedno sa neonatalnom očnom bolešću ROP, koja nepovratno narušava vid, što ukazuje na srodnu patogenezu. Međutim, specifični mehanizmi BPD i ROP ostaju nepoznati.
Vodeći istraživač Margaret L. Hibbs, dr, Laboratorija za signalizaciju leukocita, Odeljenje za imunologiju, Centralna klinička škola, Univerzitet Monaš, objašnjava: „Naša laboratorija se fokusira na upalu i njene osnovne mehanizme, a mi smo proučavali faktore koji stimulišu mijeloidne kolonije dugi niz godina. Naš prethodni rad je izvestio da je G-CSF patogen u hroničnoj opstruktivnoj plućnoj bolesti (HOBP), a drugi su sada pokazali da se to javlja kod astme.“
„S obzirom na veze između rane bolesti pluća u životu i HOBP, činilo se razumnim pretpostaviti da G-CSF takođe može biti umešan u neonatalnu bolest pluća BPD.“
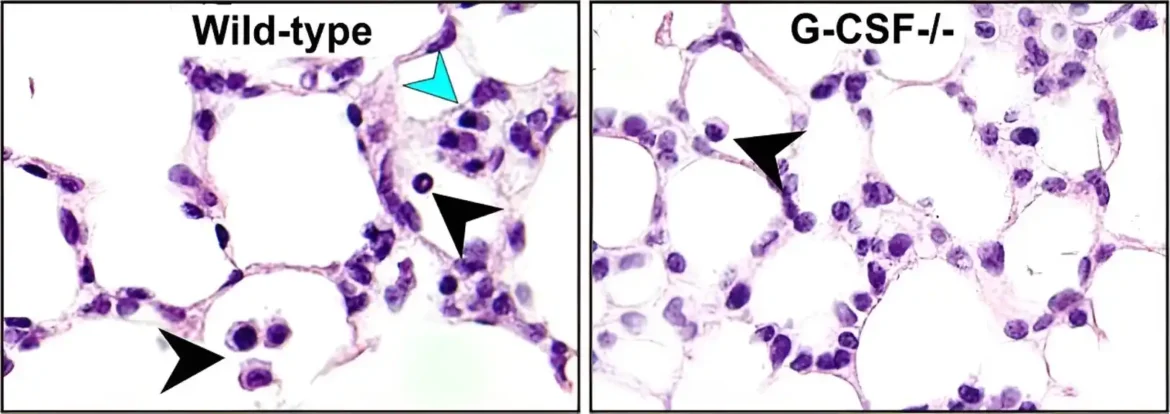
Istraživači su koristili neonatalni mišji model koincidentnog BPD-a i retinopatije da bi otkrili kandidate za medijatore. Jednak broj muških i ženskih miševa nasumično je dodeljen normoksiji (21% kiseonika) ili hiperoksiji (75% kiseonika) i izloženi su u roku od 12 sati od rođenja.
Studija je otkrila da je G-CSF značajno indukovan u tečnosti za ispiranje pluća i plazmi miša kao odgovor na hiperoksiju. Ovo je potvrđeno kod bolesti ljudi jer su nedonoščad sa težim BPD-om imala povećan G-CSF u plazmi.
Neonatalni miševi sa nedostatkom G-CSF pokazali su značajno smanjeno oštećenje alveola i, shodno tome, pokazali minimalno oštećenje plućne funkcije nakon izlaganja hiperoksiji. Ovo je bilo povezano sa poboljšanim odgovorom na oksidativni stres, smanjenom proliferacijom epitelnih ćelija pluća, smanjenom migracijom mijeloidnih ćelija sa periferije u pluća i smanjenom aktivacijom mijeloidnih ćelija. Nedostatak G-CSF-a je takođe štitio od retinopatije, što ukazuje na široku zaštitu.
Profesor Hibs napominje: „Upala je veoma implicirana u patogenezi BPD-a, tako da smo spekulisali da bi upala zavisna od G-CSF mogla biti uključena u ovu bolest pluća, ali iznenađenje je bilo da nedostatak G-CSF-a takođe štiti od retinopatije. potrebno je učiniti kako bi se ovi nalazi proširili, nedavne studije impliciraju neutrofile u očnim bolestima kao što su ROP i dijabetička retinopatija, a G-CSF je glavni regulator preživljavanja i aktivacije razvoja neutrofila.“
Koistraživalac Evelin Tsantikos, dr, Odeljenje za imunologiju, Centralna klinička škola, Univerzitet Monash, komentariše: „Ove studije su proizvele neka iznenađenja, uključujući neočekivanu zaštitu koju je nedostatak G-CSF pružio endotelnom odeljku. Iako se ovo može odnositi na smanjeno oksidativno opterećenje, pokazalo se da su G-CSF receptori eksprimirani na endotelnim ćelijama, tako da želimo dalje istražiti ovaj nalaz.“
Prvi autor Lakshanie C. Vickramasinghe, dr, Odeljenje za imunologiju, Centralna klinička škola, Univerzitet Monash, dodaje: „Ove studije naglašavaju vrednost kolaborativnog istraživanja – ne bismo mogli da postignemo najbolje rezultate istraživanja bez uključivanja kliničkih saradnika, prof. Atul Malhotra, koji je iz prve ruke pogledao respiratorne intervencije koje se pružaju u jedinici intenzivne nege novorođenčadi; i profesorka Anne Hilgendorff i dr Alida Kindt, koje su radile translacione studije kod pacijenata sa BPD-om pokazujući značajno povišene nivoe G-CSF kod novorođenčadi sa teži BPD.“
Profesor Hibs zaključuje: „Naše studije identifikuju novi mehanizam u BPD-u koji je terapeutski podložan i može pomoći u spasavanju pluća i vida novorođenčadi od doživotnih oštećenja. Neonatalne bolesti pluća i oka se trenutno leče i leče kao nezavisni uslovi. nalazi sugerišu da je G-CSF patološki mehanizam zajednički za oboje, koji može unaprediti novu terapijsku strategiju za poboljšanje nege i dugoročnih ishoda ovih ranjivih prevremeno rođenih beba.“