Istraživački tim predvođen dr Geri Jing Vai Čanom sa Škole bioloških nauka Univerziteta u Hong Kongu (HKU), otkrio je novi mehanizam koji obezbeđuje ispravnu segregaciju DNK u ćelijskoj deobi, gde će nepravilna podela ćelija dovesti do razvoja od raka.
Nalazi tima, objavljeni u časopisu Cell Reports, fokusiraju se na uloge dva proteina, RIF1 i protein fosfataze 1 (PP1), u rešavanju ultrafinih DNK mostova. Ovi mostovi se formiraju kada su sestrinske hromatide povezane molekulima DNK zgloba tokom mitoze. Ako se ovi DNK mostovi ne mogu pravilno razdvojiti ili ukloniti, na kraju će se slomiti i izazvati oštećenje DNK u ćelijama kćeri, što može dovesti do razvoja ćelija raka.
Ljudski život počinje sa jednom ćelijom — oplođenim jajetom. Ova pojedinačna ćelija treba da se replicira i podeli na približno 37 triliona ćelija. Proces kojim ćelija replicira svoju DNK, a zatim se podjednako razdvaja u dve identične ćelije, poznat je kao mitoza, što je vitalni proces za rast i zamenu istrošenih ćelija. Međutim, jednaka segregacija DNK je jedan od najizazovnijih zadataka u mitozi.
Naša DNK je organizovana u 23 para hromozoma, od kojih se svaki replicira u dve sestrinske hromatide. Tokom mitoze, ove sestrinske hromatide se razdvajaju u dve identične ćerke ćelije. Često su povezani molekulima DNK zglobova, koji mogu da formiraju dugačke fine DNK niti poznate kao ultrafini DNK mostovi kada se dve sestrinske hromatide razdvajaju pod vučnom silom. Ako se ovi DNK mostovi ne mogu pravilno razdvojiti ili ukloniti, na kraju će se slomiti, uzrokujući oštećenje ćelija kćeri. U najgorem slučaju, ovo oštećenje DNK može potencijalno dovesti do razvoja raka.
Da bi se razjasnio detaljan mehanizam kako ćelije rešavaju DNK mostove, tim predvođen dr Geri Jing Vaj Čanom otkrio je uloge dva proteina, RIF1 i protein fosfataze 1 (PP1) u regulisanju rezolucije ultrafinih DNK mostova.
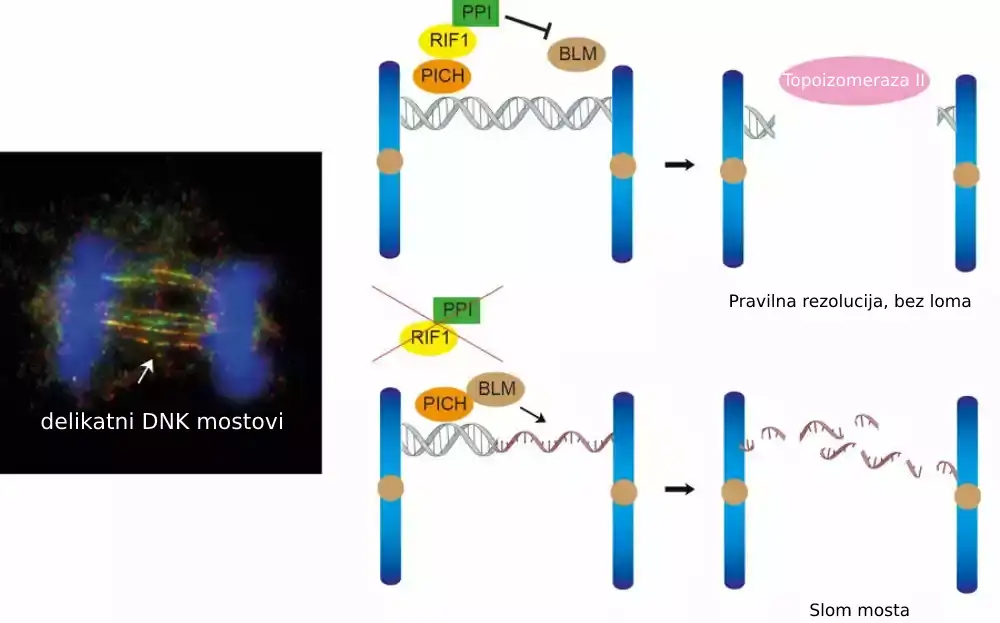
U 2007. godini, dve istraživačke grupe koje su predvodili profesor Erih Nig i profesor Ijan Hikson otkrile su postojanje ultrafinih DNK mostova identifikacijom prva dva ultrafina proteina koji vezuju most, PICH i BLM. Kasnije je RIF1 takođe identifikovan kao protein koji vezuje most. Poznato je da je PICH prvi protein koji prepoznaje DNK mostove, a zatim regrutuje BLM i RIF1 za ultrafine DNK mostove; međutim, tačan mehanizam kojim ovi proteini koji vezuju most rade na rešavanju mostova ostaje nejasan.
Da bi razumeli ulogu RIF1 u rešavanju DNK mostova, istraživački tim je upotrebio revolucionarnu tehnologiju za uređivanje genoma, CRISPR/Cas9, da iscrpi RIF1 u ćelijskom modelu tokom mitoze. Tokom čega je tim otkrio da gubitak RIF1 dovodi do povećanog formiranja oštećenja DNK i mikronukleusa usled lomljenja ultrafinih DNK mostova, jer naši podaci sugerišu da RIF1 igra ključnu ulogu u sprečavanju pretvaranja dvolančanih DNK mostova u jednolančane DNK, koja je podložnija lomljenju.
Utvrđeno je da RIF1 to postiže regrutovanjem PP1, protein fosfataze, koja smanjuje interakciju između BLM i PICH i na taj način smanjuje količinu BLM na mostovima, za koje je tim otkrio da je odgovoran za odmotavanje DNK mosta u jednolančanu DNK .
Konačno, veruje se da su dvolančani DNK mostovi zaštićeni RIF1-PP1 razrešeni drugim enzimom poznatim kao topoizomeraza IIα, koji bi mogao da posreduje u dekatenaciji dvolančane DNK kako bi se osigurala pravilna segregacija DNK.
Ovo istraživanje ne samo da baca svetlo na novi regulatorni mehanizam kojim RIF1-PP1 olakšava rešavanje DNK mostova, već i otkriva kako ultrafini DNK mostovi mogu izazvati oštećenje DNK i nestabilnost genoma ako nisu pravilno rešeni.
Nalazi sugerišu da proteini koji vezuju DNK most mogu poslužiti kao potencijalni terapeutski ciljevi za razvoj lekova protiv raka, pošto se DNK mostovi smatraju izvorom nestabilnosti genoma koji pokreće tumorigenezu.
„Otkriće da RIF1 regrutuje PP1 za mostove je prvi korak u razumevanju kako se rezolucija ultrafinih DNK mostova reguliše fosforilacijom/defosforilacijom proteina“, rekao je dr Geri Čen. „Sledeći korak je da se identifikuju ciljni supstrati kompleksa RIF1-PP1, koji može unaprediti naše razumevanje o tome kako različiti proteini koji vezuju most međusobno deluju i mogu dovesti do identifikacije novih terapijskih ciljeva za rak.